分子生物学 第十九章 真核生物的转录调控
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18 ____ ____ ___ __
/\ _`\ /\ _`\ /\_ \ /\ \__ __
\ \ \L\_\ __ ___ __ \ \ \L\ \ __ __ __ __\//\ \ __ \ \ ,_\/\_\ ___ ___
\ \ \L_L /'__`\/' _ `\ /'__`\ \ \ , / /'__`\ /'_ `\/\ \/\ \ \ \ \ /'__`\ \ \ \/\/\ \ / __`\ /' _ `\
\ \ \/, \/\ __//\ \/\ \/\ __/ \ \ \\ \ /\ __//\ \L\ \ \ \_\ \ \_\ \_/\ \L\.\_\ \ \_\ \ \/\ \L\ \/\ \/\ \
\ \____/\ \____\ \_\ \_\ \____\ \ \_\ \_\ \____\ \____ \ \____/ /\____\ \__/.\_\\ \__\\ \_\ \____/\ \_\ \_\
\/___/ \/____/\/_/\/_/\/____/ \/_/\/ /\/____/\/___L\ \/___/ \/____/\/__/\/_/ \/__/ \/_/\/___/ \/_/\/_/
/\____/
\_/__/
____ __ __
__ /\ _`\ /\ \ /\ \__
/\_\ ___ \ \ \L\_\ __ __\ \ \/'\ __ _ __ __ __ ___\ \ ,_\ __ ____
\/\ \ /' _ `\ \ \ _\L /\ \/\ \\ \ , < /'__`\ /\`'__\/\ \/\ \ / __`\ \ \/ /'__`\ /',__\
\ \ \/\ \/\ \ \ \ \L\ \ \ \_\ \\ \ \\`\ /\ \L\.\_\ \ \/ \ \ \_\ \/\ \L\ \ \ \_/\ __//\__, `\
\ \_\ \_\ \_\ \ \____/\ \____/ \ \_\ \_\ \__/.\_\\ \_\ \/`____ \ \____/\ \__\ \____\/\____/
\/_/\/_/\/_/ \/___/ \/___/ \/_/\/_/\/__/\/_/ \/_/ `/___/> \/___/ \/__/\/____/\/___/
/\___/
\/__/
本章概要
真核细胞和基因的额外特征:
- 核小体及其修饰物: 真核生物的基因组包裹在组蛋白中形成核小体。但对核小体的修饰也为调控提供了新的机会。
- 更多的调控因子和更密集的调控序列: 在细菌中, 单个调控因子与小段序列结合;而在真核细胞中, 与细菌相比, 这种结合位点数目更为庞大, 位置更加远离转录起始点。
启动子(promoter): 与基因表达启动相关的顺式作用元件, 是结构基因的重要成分。它是一段位于转录起始点5’端上游区100-200bp以内的具有独立功能的DNA序列, 能活化RNA聚合酶, 使之与模板DNA准确的相结合并具有转录起始的特异性。
调控因子结合位点(regulator binding site): 单一结合区域称为调控因子结合位点。
调控因子序列(regulatory sequence): 一个基因上包含所有调控因子结合位点的DNA片段称为调控因子序列。
增强子(Enhancer): 是一个顺式作用序列, 增强子可位于转录起始位点5’或3’末端, 而且一般与所调控的靶基因的距离无关, 能使和它连锁的基因转录频率明显增加。
绝缘子(Insulator): 或称边界元件(boundary elements), 是真核生物基因组的调控元件之一。功能为阻止临近调控元件, 对它所界定基因的启动子起增强或者阻遏的作用。它对增强子的抑制作用具有极性, 即只对处于其所在边界另一侧的增强子有抑制作用, 而并不能抑制与其处于同一结构域的增强子。
绝缘子在基因工程中的应用: 随机插入到哺乳动物基因组的基因常常会”沉默”, 在该基因的上游和下游插入绝缘子可以使该基因不再”沉默”。
转录沉默(Transcriptional Silencing): 是一种可沿着染色质传播的特殊抑制形式, 不需要与各自的抑制子结合, 多个基因的表达就可被关闭。
调控基因(regulatory gene): 是编码能与操纵序列结合的调控蛋白的基因, 与之结合的调控蛋白分为阻遏蛋白和激活蛋白, 能够调控基因转录。阻遏蛋白介导的调控方式为负性调控, 激活蛋白所介导的调控为正性调控。
转录调控原理
可诱导基因的表达受到胞外信号的调节, 这些信号通过调节蛋白(Regulatory Protein)传递给基因。正调控子或活化子(Positive regulator or activator): 一类增强所控制基因的转录的调节蛋白。激活机制包括募集和变构。
负调控子或抑制子(Negative regulator or repressor): 一类降低或消除所控制基因的转录的调节蛋白。抑制机制包括: 阻止启动子结合、阻止向开放复合物的转变和阻止启动子逃离。
原、真核表达调控的相似点:
- 调控原理是相同的:
外界信号(signal)刺激、胞内活化子(activator)和抑制子(repressor)传递信号、通过募集(recruitment), 变构(allostery)和协同结合(cooperative binding)的方式发挥作用。 - 调控发生的阶段相似, 主要发生在转录起始阶段。
原、真核表达调控的不同点:
- 真核生物的调控可发生在Pre-mRNA的剪接阶段, 这是原核生物调控所没有的。
- 真核转录机器更复杂, 受到更多样的调控。
- 核小体及其修饰物影响基因的转录。
- 许多真核基因有多个的调控蛋白结合位点, 因此受到更多调控蛋白的调控
从酵母到哺乳动物转录调控的保守机制
真核转录活化子的结构特征
酵母是最易于作遗传和生化分析的单细胞真核生物, 对它的研究提供了大量关于真核基因表达调控中抑制子和活化子作用方式的知识。
因为核小体结构和基因转录的相似性, 真核基因的表达调控基本特点是相同的。真核生物活化子(activator)的作用方式基本与细菌的相似。
真核生物抑制子(Repressor)的作用方式多种多样。
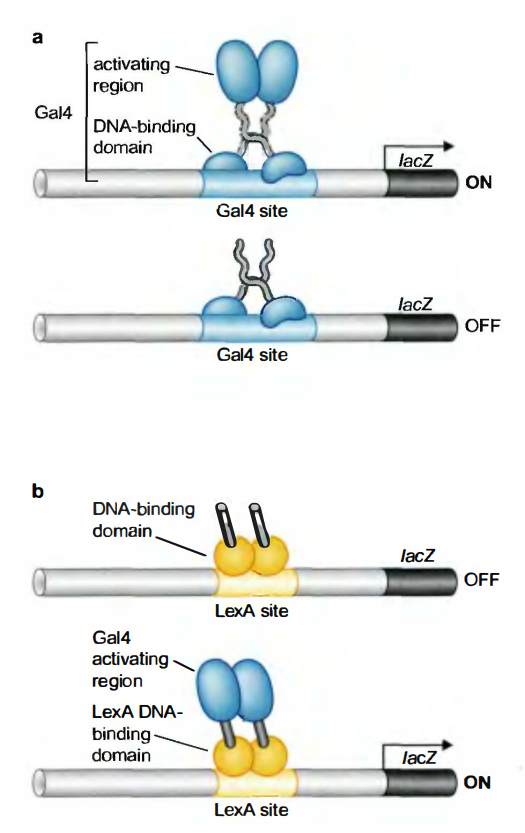
活化子的DNA结合区和转录激活区是分开的
已有实验证据表明Gal4的DNA结合区和转录激活区是分开的。
- 域交换实验: 表达GAL4基因的片段(编码这个激活因子N端的1/3), 得到的蛋白质能与DNA正常结合, 但是不能激活转录过程。这样的蛋白质包含DNA结合域, 但是缺乏激活域, 因此Gal4的DNA结合区和转录激活区是可以分离开来分别其作用的。
- 酵母双杂交检测(two hybrid assay): 另一个实验构建了一个杂合的基因, 该基因将编码Gal4蛋白C端2/3的序列, 同细菌抑制因子蛋白LexA的DNA结合域融合。产生的蛋白质在酵母中同个报道质粒起表达, 该质粒GAL1启动子的上游具有LexA结合位点。融合蛋白能激活该报道子的转录。实验表明, 激活不单单是通过与DNA结合来介导的, 相反, DNA结合域的作用仅仅是将激活域与启动子联系在一起。
真核调节蛋白DNA结合域的结构特征
细菌调节蛋白: 多数运用螺旋-转角-螺旋基序(helix-turn-helix motif)与目标DNA结合。多数以二聚体的形式与DNA结合, 每个单体以一个α螺旋插入大沟。
真核调节蛋白: 与原核识别DNA的原理相似, 但细节上有所不同。除以同源二聚体(homodimer)与DNA结合外, 有些形成异源二聚体(heterodimer), 扩大了识别的特异性。
DNA结合结构域: 指转录调控蛋白等可以和DNA上特异序列结合的结构域, 几种典型的DNA结合域为螺旋-转折-螺旋, 锌指结构, 亮氨酸拉链和螺旋-环-螺旋等。大多数真核细胞的DNA结合蛋白经常以二聚体的形式与DNA结合, 并以α螺旋嵌入大沟来识别特定的DNA序列。
- 同型结构域蛋白质(Homeodomain protein): 是一类具有螺旋-转角-螺旋基序(helix-turn-helixmotif)DNA结合域的蛋白, 其与DNA结合的方式与细菌调节蛋白相同。
- 含锌DNA结合域有两种形式
- 锌指蛋白(zinc finger protein):
- 锌簇(zinc cluster)域:
- 亮氨酸拉链结构域(leucine zipper motif): 该结构域是在单一的结构单元内同时包含二聚结构和与DNA结合的表面。两个长的α螺旋形成一个钳形结构, 将DNA夹于其中, 每个α螺旋嵌入大沟的一半转折部分。二聚化是由同样两个α螺旋内另一个区域介导的:在这个区域内, 它们形成一个短的盘绕状结构, 在这个结构中两条α螺旋通过适当间隔的亮氨酸残基(或其他疏水性氨基酸残基)之间的疏水相互作用结合到一起。有亮氨酸拉链结构的蛋白质经常形成异二聚体, 也形成同型:二聚体。
- 螺旋-环-螺旋结构域(The helix-loop-helix): 每个单体中延伸的α螺旋区域嵌入DNA的大沟中。二聚体的表面由两个螺旋区域构成, 一个是参与DNA识别的那个螺旋的一部分, 另一个是一个较短的α螺旋。这两个螺旋被一个非刚性的环分离, 这个环容许两段螺旋靠近。由于与DNA结合的α螺旋区域内包含碱性氨基酸残基, 亮氨酸拉链和HLH蛋白经常被称为碱性拉链(basic zipper)和碱性HLH蛋白(basicHLHprotein)。
激活区域不确定性
激活区根据氨基酸组成进行分组:
- 酸性激活区(Acidic activation region): 酸性氨基酸和疏水氨基酸对于本区的作用非常重要, 如Gal4。
- 富含谷氨酰胺区(Glutamine-rich region): 哺乳动物活化子SP1。
- 富含脯氨酸区(Proline-rich region): 哺乳动物活化子CTF1。
通过真核生物激活因子募集结合基因的蛋白复合物
活化子通过募集和远距激活的方式激活真核转录
像细菌中一样, 真核活化子也通过募集RNA pol的方式发挥作用, 只是对于多聚酶的募集是间接的:
- 与转录机器上多聚酶以外的某一部分发生相互作用, 从而将转录机器募集到基因。
- 募集核小体修饰物, 改变基因附近的染色质结构, 有利于基因的活化。
真核基因表达调控中没有变构激活
对于大多数真核基因而言, 转录机器在没有受到激活时并不预先与启动子结合, 因此在真核基因表达调控中没有发现变构激活。
活化子将转录机器募集到基因
真核转录机器是多聚酶和多种蛋白的复合物, 这些蛋白有: 中介蛋白(Mediator)和TF II D复合物。活化子与这些蛋白中的一种或几种相互作用, 将转录机器募集到基因。
实验介绍1: ChIP染色质免疫共沉淀(Chromatin Immuno-precipitation, ChIP): ChIP被用于观察调节蛋白与基因组的哪一部分结合。
实验介绍2: 活化子旁路实验(Activator Bypass Experiment): 通过中介蛋白与DNA的直接联系来激活转录。在缺乏通用激活因子Gal4的条件下, GALI基因被一个融合蛋白所激活, 该蛋白由LexA的DNA结合域与中介蛋白复合物的一个组分融合而成。激活依靠LexA的DNA结合位点嵌入基因的上游。其他转录起始所必需的组分(TFIID等)假设同中介蛋白及RNA聚合酶II结合在一起。
活化子也募集核小体修饰物来帮助转录装置结合到启动子上或起始转录
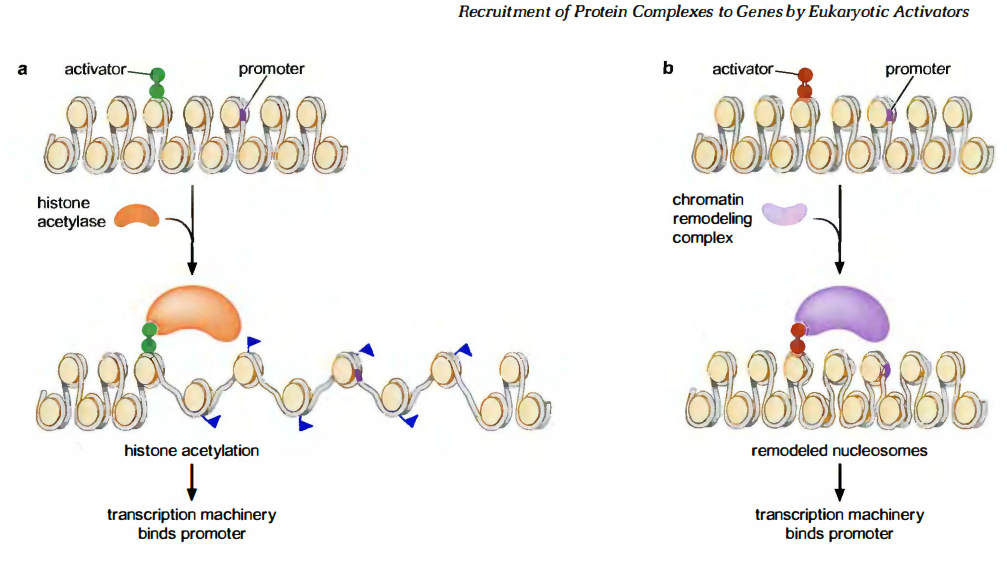
募集核小体修饰物有助于激活染色质(chromatin)内那些难以接触到的基因。
核小体修饰物有两种形式:一种是增加组蛋白末尾的化学基团,如增加乙酰基团的组蛋白乙酰转移酶( histoneacetyl transferase,HAT);另一种则替换(或“重塑”)核小体,如依赖ATP 活性的SWI/SNF。
这些修饰物如何帮助基因激活的呢?
- 首先,重塑模型和某些修饰能够暴露 DNA 核小体内部的那些无法接近的结合位点。组蛋白末端增加乙酰基团,改变了组蛋白末端与邻近核小体的相互作用。这种改变常被说成松弛了染色质的结构,将这些位点释放。
- 增加乙酰基团也以另一种方式协助转录装置(或其他蛋白)的结合:在核小体上为具有所谓同源调节域( bromodomain )的蛋白质提供特殊的结合位点。TF ID 复合物的一个组分就具有同源调节域,与没有乙酰化的核小体相比,更易于与乙酰化的核小体结合。因此,若某个基因的启动子具有乙酰化的核小体,与那些没有乙酰化核小体的基因相比,将可能具有对转录装置更高的亲和力。其他的蛋白质含有染色质结构域( chromodomainl),可以识别甲基化的核小体。
在某些启动子上激活因子募集另一个因子来进行有效的起始和延伸
在某些基因中, 启动子下游的序列导致聚合酶在起始后不久就暂停或停滞。这些基因中, 某些延伸因子的存在与否极大地影响了基因表达的水平。
活化子的远距离作用:环和绝缘子
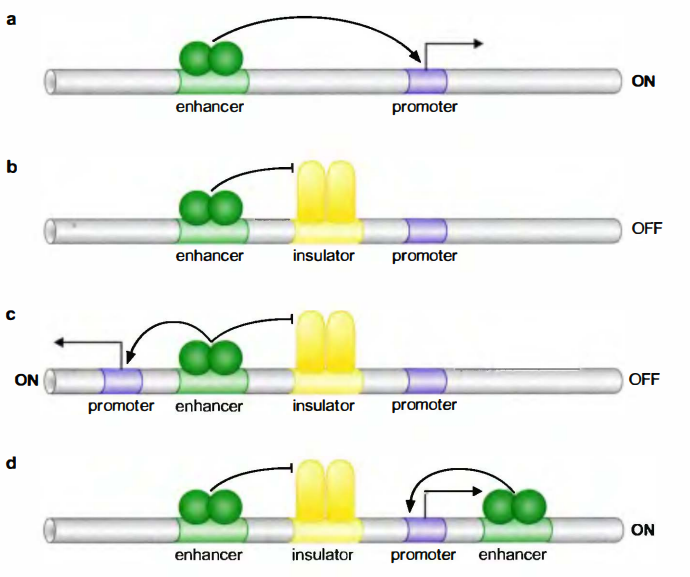
许多真核生物, 特别是高等真核生物的活化子可在离目标基因很远的地方发挥作用。增强子也许能在它们所控制基因的上游(或下游)数十个甚至上百个kb的地方找到。
生物体存在着帮助远距离结合的蛋白质之间交流的机制。
在果蝇中, cut基因被100kb以外的一个增强子所激活。一种名为Chip的蛋白质, 有助于增强子和基因之间的交流。Chip蛋白的编码基因突变影响激活的效率。其中一个模型是该蛋白质同增强子和启动子间DNA上多个位点结合, 通过多个Chip蛋白之间的相互作用, 在中间的DNA上形成多个小环, 这样的累积效果将使启动子和增强子接近。
在真核生物中还有其他几类模型: DNA包在核小体中, 被多个碱基对分开的位点也许在细胞中实际分开的距离并没有想像中那么远。而且在染色质某些位置也形成特殊结构, 使增强子和启动子靠近。
什么阻止增强子激活那些启动子在这个距离内的其他基因呢?
一种名为绝缘子(insulator)的特殊元件控制了激活因子的行动。当置于增强子和启动子之间时, 绝缘子将抑制增强子对基因的激活作用。绝缘子并不抑制位于启动子下游的另一个增强子对同基因的激活作用:同样, 它也不抑制最初的激活因子对另个基因的作用。因而, 与绝缘子结合的蛋白质既不积极地抑制启动子的活性, 也不抑制激活因子的激活作用, 它们只是阻碍着两者之间的联系。
染色质上组蛋白修饰抑制的传播是转录沉默(transcriptional silencing)现象的核心。沉默是一种特殊的抑制形式, 能沿着染色质展开, 关闭多个基因的表达无需特殊的抑制因子与基因结合。绝缘子元件能够阻断沉默的展开, 所以绝缘子能使基因免于不加选择的激活作用和抑制作用。
随机插入哺乳动物基因组的基因经常处于沉默状态, 但是若在该基因的上、下游放上绝缘子, 该基因将不呈现沉默状态。
信号整合与组合控制
活化子协同作用促进信号整合
在多细胞生物中, 信号整合应用得更加广泛。每个信号是通过独立的调控因子传达给基因的。在很多基因中, 多个激活因子必须联合作用来打开基因。
协同(synergistically)作用: 当多个激活因子联合作用时, 效果要好于(通常是非常明显的)每个激活因子单独作用的效果之和。
协同有三个来源
- 多个激活因子各募集转录装置的同一组分;
- 多个激活因子各募集转录装置的不同组分;
- 多个激活因子相互之间帮助与所调控基因上游的位点相结合。
通过与不同的部位接触, 两个激活因子能募集同一复合体, 如中介蛋白。组合的结合能对募集有指数效果(不是简单的加和)。
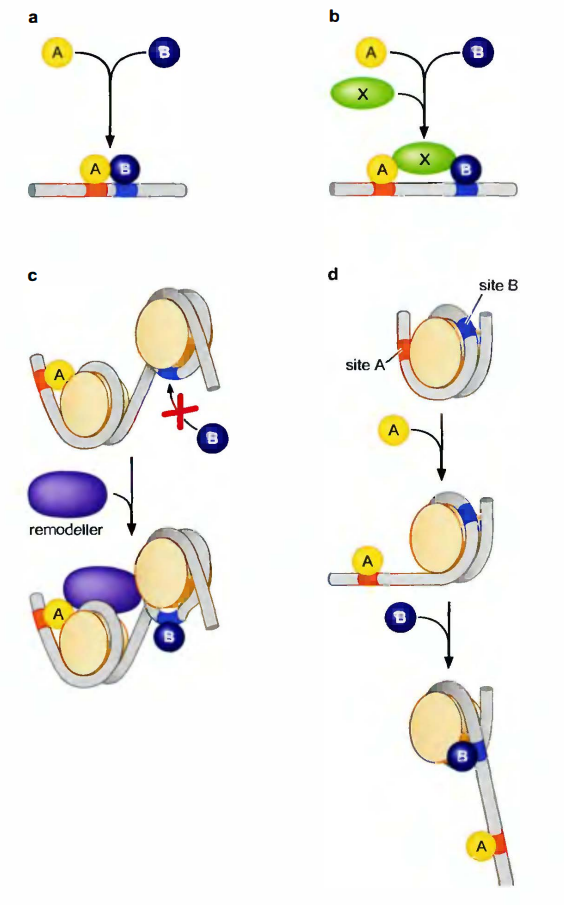
活化子协同与DNA结合的4种方式
- 蛋白质与DNA位点的结合促进另一蛋白质与邻近位点的结合。
- 两个蛋白质通过直接的相互作用来协作与DNA结合。
- 两个蛋白质与共有的第三个蛋白质作用来实现类似的作用。
- 蛋白质与核小体内DNA位点的结合促进另一蛋白质结合的间接方式。
- 第一个蛋白质募集核小体重塑分子来使第二个蛋白质的结合位点暴露。
- 第一个蛋白质与它的位点结合, 这个DNA位点恰巧在核小体外。结合后稍微展开了的核小体DNA暴露第二个蛋白质的结合位点。
活化子协同与DNA结合的四种方式
- “经典”协同结合。
- 2种蛋白同时与第三种蛋白结合。
- A蛋白募集核小体重塑蛋白, 使被屏蔽的B蛋白的结合位点显露出来。
- A蛋白与DNA的结合使核小体解旋, 使被屏蔽的B蛋白的结合位点显露出来。
HO基因受到2种调控蛋白的控制:SWI5募集核小体修饰物;SBF募集中介蛋白
啤酒酵母(S. cerevisiae)HO蛋白与酵母的出芽裂殖特性有关。HO基因受到2个活化子SWI5和SBF的共同调控, 只在母细胞周期的某一时刻才能表达。
SWI5: 只在母细胞中才有活性, 与远离目标基因的多个位点结合, 募集酶类, 打开SBF的结合位点。
SBF: 只在细胞周期的某个阶段有活性, 没有SWI5的协助就不能与DNA结合。
活化子协同与DNA结合方式为上文提到的方式3: SWI5蛋白募集核小体重塑蛋白, 使被屏蔽的SBF蛋白的结合位点显露出来。
活化子在人类β-干扰素基因上的协同结合
增强体(enhanceosome): 病毒感染能激活细胞内人类β干扰素基因, 在人类β干扰素基因启动子上游约1kb处有一个增强子, 3个激活因子将协同地一个挨着一个与该增强子结合, 这些激活因子以协同作用结合在增强子上形成的结构被称为增强体。
协同方式:
- 活化子间存在相互作用。
- HMG-Ⅰ与增强子结合, 弯曲DNA, 启动活化子间的协助结合。
活化子协同与DNA结合方式为方式1: “经典”协同结合, 2中蛋白间的直接互作。HMG-Ⅰ在细胞中持速活化, 并在INF-β基因活化中起着”建筑框架”的作用。
组合控制是真核细胞的复杂性与多样性的核心所在
组合控制(Combinatory control):是真核生物复杂性和多样性的核心内容。在组合控制中,激活蛋白和阻遏蛋白共同起作用。在真核细胞中存在着广泛的联合控制。
基因A受4个信号(分别为1、2、3、4)的控制, 每个信号通过一个独立的激活因子(即激活因子1、2、3、4)来起作用。基因B受3个信号(分别为3、5、6)的控制, 这些信号通过对应的3个激活因子来起作用。在复杂的多细胞生物(如果蝇和人类)中, 联合控制涉及比上例中更多的调控蛋白和基因, 抑制因子和激活因子都可能参与。
酿酒酵母(S. cerevisiae)交配型基因的组合控制
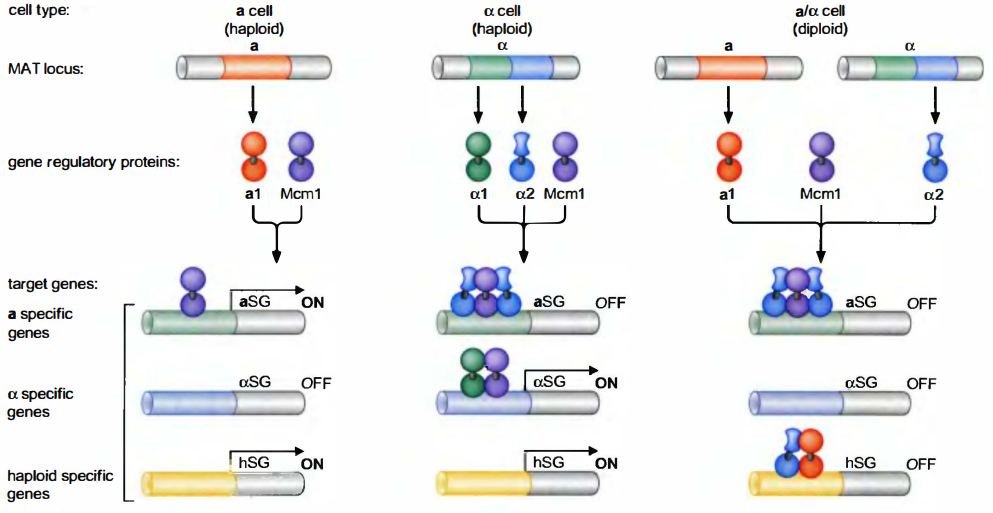
啤酒酵母(S. cerevisiae)有3种存在形式:
两种交配型单倍体细胞(haploid cell): a和α。
一种二倍体细胞(diploid cell): a/α, 由一个a和一个α细胞交配、融合而成。2种交配型细胞是不同的, 它们各自表达a特异基因和α特异基因。a细胞产生调节蛋白a1。α细胞产生调节蛋白α1和α2。两类细胞都产生第四个调节蛋白: Mcm1参与交配型特异基因的表达调控。
- a细胞中, α细胞特异基因是关闭的, 因为没有活化子在那里结合;a细胞特异基因是打开的, 因为Mcm1在那里结合并活化这些基因。
- 在α细胞中, α细胞特异基因是打开的, 因为Mcm1在启动子上游结合并活化基因的表达。这这些基因中, Mcm1结合在弱结合位点而且只能与蛋白α1单体协作发挥作用。Α细胞中a细胞特异基因由于α2抑制子的存在而保持关闭。这些抑制子以二聚体形式结合并且与Mcm1在这些基因中协作发挥作用。α2抑制子的两种特性保证了a细胞特异基因不在这里表达: 它覆盖了Mcm1的活化区使这个蛋白质无法表达;它同时还有效地抑制这些基因。
- 在二倍体细胞中, a细胞特异基因和α细胞特异基因都关闭。其形成如下: a细胞特异基因结合Mcm1和α2, 与其在α细胞中一样, 这些基因保持关闭。α细胞特异基因保持关闭, 因为在a细胞中没有活化子的结合。
- 两种单倍体细胞(a和α)表达另外一类基因叫做单倍体特异基因(haploid-specificgene)。这些基因在二倍体细胞被α2关闭, 后者在基因的上游与a1形成异二聚体与其结合。只有在二倍体中才同时存在这两种调节子。
转录抑制因子
真核生物中, 大多数抑制子不是与位于启动子区的结合位点结合而阻止多聚酶的结合, 与细菌中的常用方式不一样。
真核转录的抑制子的调控方式: 同激活因子一样, 抑制因子可以募集核小体修饰酶, 但在这里, 这个酶的作用与激活因子募集的相反, 它们使染色质更紧凑或者去除能够被转录装置识别的基团。(组蛋白脱乙酰酶(histone deacetylase)通过从组蛋白尾部去除乙酰基来抑制转录。其他的酶在组蛋白的尾部加上甲基, 这个反应常常抑制转录。)
真核生物抑制因子的作用方式:
- 通过与激活因子结合重叠位点的结合, 抑制因子抑制激活因子对基因的结合, 因而阻断基因的激活。
- 抑制因子与激活因子旁边的位点结合, 并与激活因子相互作用, 位阻它的激活区。
- 抑制因子与基因上游的位点结合, 通过与转录装置的特殊方式作用, 抑制转录起始。
- 通过募集组蛋白修饰酶改变核小体, 从而抑制转录。
信号转导与转录调控因子的控制
信号经常通过信号传导途径被传递到转录调节子
环境信号/信息:
(1)小分子物, 如糖、组胺。
(2)由一个细胞释放而被另一个细胞接收的蛋白质。
在真核细胞中, 大多数信号通过信号传导途径间接地传递给基因, 信号在最初受体位于细胞膜上。
对于简单的细菌来说, “信号”和”信息”没有差别。但是, 一旦涉及信号转导通路, 这两者就不同了。在真核细胞中, 我们将看到大多数信号是沿着信号转导通路将信息传递至基因的, 这些信号转导通路有时是非常精密的。
在信号转导通路中, 起始配体通常由特异的细胞表面受体(cell surface receptor)检测到:配体与受体细胞外的某个区域结合, 这种结合的信息被转递至该受体的细胞内区域。可以通过受体的变构改变来实现。配体也可以简单地使两条或多条的受体链聚集, 使这些受体的细胞内区域间通过交互作用而互相激活。
信号转导通路例子:
- STAT(signal transdncer andactivator of transcription)通路: 当受体被其配体(细胞因子)激活, 就会导致两条受体链聚集, 引发每条链中的激酶激活来使对应受体细胞内区域的一段特殊序列磷酸化。此磷酸化位点随后被一个特殊的STAT蛋白识别。而STAT蛋白一旦与上述磷酸化位点结合后, 其自身也被磷酸化。STAT蛋白磷酸化后, STAT蛋白二聚化, 向细胞核中转移, 并与DNA结合。
- 控制激活因子(如Jun)的分裂素激活蛋白激酶(MAPK)通路: Jun是我们前面(图19-18)提到的β干扰素增强子上作用的激活因子。在这个例子中, 被激活的受体诱导一系列的信号事件, 最后导致一种MAPK激活, 后者进一步磷酸化Jun(及其他转录调控因子)。信息沿着信号转导通路传递, 最普遍的方式是通过磷酸化。此外, 也会使用蛋白酶解、去磷酸化及其他修饰作用。
信号传导途径(Signal transduction pathway):
- 起始信号/配体(ligand)与细胞表面特异受体的胞外区结合。
- 信号被传递到受体的胞内区(通过受体的变构或二聚化)。
- 信号接着被接力传递到相关的转录调控子。
- 转录调控子控制目标基因的表达。
信号通过多种方式控制真核细胞转录调控因子
在真核生物中, 信号可通过直接或间接的方式传递给转录调节子。其机制有:
激活区的暴露
- 构象的变化使原来被包埋的激活区显露出来。
- 释放原来被遮蔽的蛋白。如: 活化子Gal4在没有半乳糖时会被Gal80结合并遮蔽起来。
运输出入细胞核:
没有被活化时, 许多活化子和抑制子停留在细胞质中, 信号刺激使它们进入细胞核去发挥调控作用。
组蛋白与DNA修饰导致的基因“沉默”
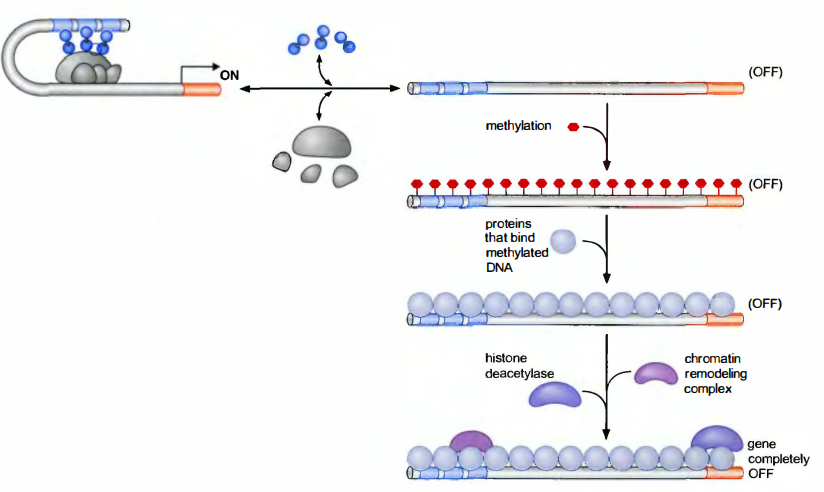
转录可以通过DNA甲基化而被沉默。DNA甲基化是由DNA甲基化酶(DNA methylase)所催化。DNA序列的甲基化能抑制(DNA序列与)蛋白质结合, 包括转录机器, 因而阻断基因的表达。但是甲基化也可以通过其他途径抑制表达: 有些序列只有在被甲基化后才能被特异的抑制子识别, 这种识别随后关闭附近的基因, 通常由募集组蛋白脱乙酰酶来实现。
在酵母中,沉默由组蛋白的脱乙酰化作用和甲基化作用介导
在酿酒酵母中, 端粒、沉默的交配型基因座及rDNA基因都是”沉默”的区域。
以端粒为例: 现已发现, 每条染色体末端1~5kb部分均是折叠、致密的结构。来自染色体其他位点的基因转移到该区后, 通常都变成沉默状态, 端粒部分的染色质乙酰化程度要轻一些。
显示了3个编码沉默调控蛋白的基因, 即SIR2、SIR3和SIR4(SIR代表silentinformationregulator)。这3个基因所编码的蛋白质形成一个复合物, 与沉默状态的染色质结合, 其中Sir2是一种组蛋白脱乙酰酶。
沉默复合物由识别端粒重复序列的DNA结合蛋白募集到端粒。在沉默的交配型基因中, 募集也是由一个特异的DNA结合蛋白起始的。Sir的募集激发了组蛋白尾的局部脱乙酰化。脱乙酰化的组蛋白随后被沉默复合物直接识别, 因此局部脱乙酰化以自我永续的方式沿着染色质轻易地扩散开, 产生了一个扩展的异染色质区域。
尽管因Sir识别脱乙酰组蛋白而引发脱乙酰化的加剧和扩散, DNA结合蛋白继续扮演重要的角色。是DNA结合蛋白赋予了整个过程的特异性, 即决定了沉默复合物在哪里形成。
沉默区域的扩散是如何被节制的?绝缘子元件能够阻碍组蛋白修饰的扩散。另外, 其他种类的组蛋白修饰阻碍Sir2蛋白的结合, 于是终止了扩散。相信组蛋白H3尾的甲基化起了这个作用。
在哺乳动物中DNA甲基化与沉默状态的基因有关
有些哺乳动物基因由于其邻近DNA序列的甲基化而处于沉默状态(DNA甲基化, 而非组蛋白甲基化)。哺乳动物基因组上大段的区域正是通过这种方式被标记的, 并且DNA甲基化通常出现在异染色质区域。这是因为甲基化的序列常被DNA结合蛋白(如MeCP2)识别。DNA结合蛋白可以募集组蛋白脱乙酰酶和组蛋白甲基化酶, 而这两种酶可以修饰邻近的染色质。DNA甲基化可以标记随后异染色质形成的位点。
DNA甲基化在一种被称为印记(imprinting)的现象中处于核心地位。在一个二倍体细胞中, 多数基因有两份拷贝:其中一条染色体上的一份拷贝来自父方, 另外一条对应染色体上的拷贝来自母方。在多数情况中, 两个等位基因表达水平具有可比性。在少数情况下, 只有其中一份拷贝的基因表达, 而另一份拷贝处于沉默状态。
有两个调控序列对于上述两个基因差异性的表达起关键作用:一个增强子序列(位于H19基因的下游)和一个绝缘子序列(称为印记控制区ICR,imprinting control region,位于HI9和Igf2基因中间)。
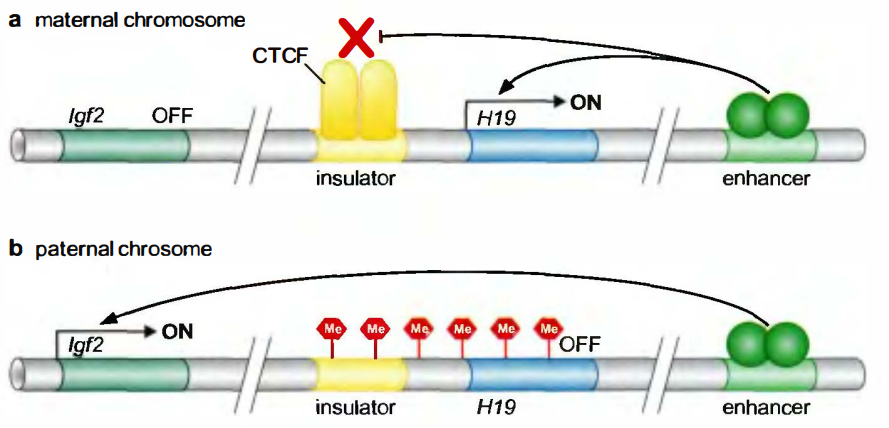
该染色体上ICR与一种叫做CTCF的蛋白质结合, CTCF阻断激活因子在增强子序列处激活Igf2基因。在父本染色体上, ICR元件和H19启动子均被甲基化。转录装置不能与H19启动子结合, 而且CTCF不能与ICR结合。增强子此时可以激活Igf2基因。在父本染色体上, 通过MeCP2与甲基化的ICR结合, HI9基因被进一步抑制。同前, 这种作用可以募集脱乙酰化酶, 而后者又抑制了H19启动子。
基因的表观遗传调控
表观遗传调控(epigenetic regulation): 基因表达的模式有时必须得到继承。在发育中一个细胞释放的信号导致邻近细胞开启特异的基因。这些基因也许不得不在这些细胞的许多代内都保持开启, 即使诱导它们开启的信号只瞬间存在。在同时缺乏突变和起始信号的情况下, 基因表达模式的继承称为表观遗传调控。
基因表达的某些状态通过细胞分裂得以继承,即使起始信号不再存在
溶源性状态通过细胞分裂得以维持便是表观遗传调控的一个例子。这个表观遗传控制源自于一个抑制因子合成的两步策略:
第一步, 抑制因子合成通过激活因子CII(其对生长条件敏感)对抑制因子(CI)基因的激活而建立。
第二步, 抑制因子合成通过自我调控得以维持:抑制因子激活自身基因的表达。通过这条途径, 当溶源性细胞分裂时, 每个子细胞继承了一个拷贝的处于休眠状态的噬菌体基因组和一些抑制因子蛋白。这些抑制因子足以在每个细胞中从噬菌体基因组上刺激进一步的抑制因子合成。
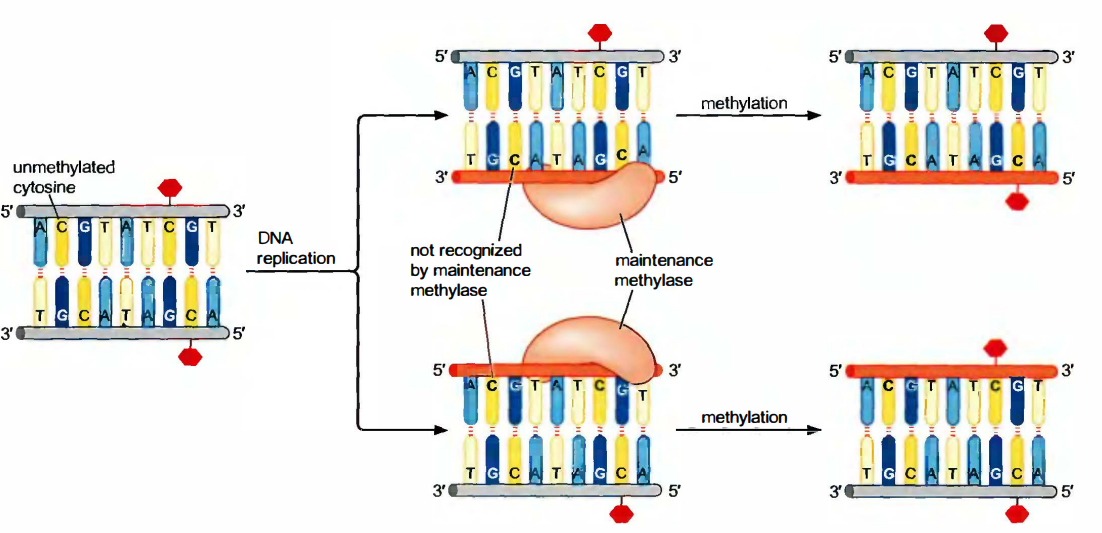
另一个著名的表观遗传调控的机制源于DNA甲基化, 在对印记的描述中我们见过这样一个例子:DNA甲基化轻易通过细胞分裂继承下来。如此, 某些特定的DNA甲基化酶可以低频地甲基化先前未修饰的DNA,但所谓的维持甲基化酶(maintenance methylases)极其有效地修饰半甲基化的DNA(即完全甲基化的DNA经复制后提供的那个底物)。
在哺乳动物细胞中, DNA甲基化可能是沉默的基因组区域的主要标记。DNA复制后, 在两个子细胞中的半甲基化位点被重新甲基化。
它们随后可以被抑制因子MeCP2所识别, 然后后者募集组蛋白脱乙酰酶和甲基化酶, 重新建立沉默。
考点补充
名词补充