分子生物学 第十八章 原核生物的转录调控
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18 ____ ____ ___ __
/\ _`\ /\ _`\ /\_ \ /\ \__ __
\ \ \L\_\ __ ___ __ \ \ \L\ \ __ __ __ __\//\ \ __ \ \ ,_\/\_\ ___ ___
\ \ \L_L /'__`\/' _ `\ /'__`\ \ \ , / /'__`\ /'_ `\/\ \/\ \ \ \ \ /'__`\ \ \ \/\/\ \ / __`\ /' _ `\
\ \ \/, \/\ __//\ \/\ \/\ __/ \ \ \\ \ /\ __//\ \L\ \ \ \_\ \ \_\ \_/\ \L\.\_\ \ \_\ \ \/\ \L\ \/\ \/\ \
\ \____/\ \____\ \_\ \_\ \____\ \ \_\ \_\ \____\ \____ \ \____/ /\____\ \__/.\_\\ \__\\ \_\ \____/\ \_\ \_\
\/___/ \/____/\/_/\/_/\/____/ \/_/\/ /\/____/\/___L\ \/___/ \/____/\/__/\/_/ \/__/ \/_/\/___/ \/_/\/_/
/\____/
\_/__/
____ __ __
__ /\ _`\ /\ \ /\ \__
/\_\ ___ \ \ \L\ \_ __ ___\ \ \/'\ __ _ __ __ __ ___\ \ ,_\ __ ____
\/\ \ /' _ `\ \ \ ,__/\`'__\/ __`\ \ , < /'__`\ /\`'__\/\ \/\ \ / __`\ \ \/ /'__`\ /',__\
\ \ \/\ \/\ \ \ \ \/\ \ \//\ \L\ \ \ \\`\ /\ \L\.\_\ \ \/ \ \ \_\ \/\ \L\ \ \ \_/\ __//\__, `\
\ \_\ \_\ \_\ \ \_\ \ \_\\ \____/\ \_\ \_\ \__/.\_\\ \_\ \/`____ \ \____/\ \__\ \____\/\____/
\/_/\/_/\/_/ \/_/ \/_/ \/___/ \/_/\/_/\/__/\/_/ \/_/ `/___/> \/___/ \/__/\/____/\/___/
/\___/
\/__/
转录调控的原理
基因表达由调控蛋白控制
调控蛋白可分为两类:
- 正调控蛋白或活化子(activator, 又译激活物);
- 负调控蛋白或抑制子(repressor, 又译阻遏物)。
这些调控蛋白通常都是DNA结合蛋白, 它们识别受其控制的基因上的或基因附近的特异位点。活化子增强受控基因的转录, 抑制子降低或消除相应基因的转录。
持家基因(House-keeping gene): 所有细胞都要表达的一类基因, 对复制和生长等基本细胞生命过程很重要。
可诱导基因(Inducible gene): 只有受到诱导子或细胞因子的激活作用时才会表达的基因称为可诱导基因。
大多数的激活因子和抑制因子在转录起始水平发挥作用
为什么大多数的激活因子和抑制因子在转录起始水平发挥作用?
- 转录起始阶段是进行调控的最积极有效的阶段, 也就是说, 在最开始决定这个基因是否被表达能够避免能量和资源的浪费。例如, 部分的mRNA将不会被使用(翻译)。
- 在最开始的时候进行调控更容易做好。在单倍体基因组中每个基因只有一个单拷贝, 所以在一个单链DNA分子上也只有一个启动子调控特定基因的表达。相反, 为了调控即将翻译的基因, 每个mRNA分子都必须发挥作用。
为什么不是全部的调控都集中在转录的起始阶段?
- 它允许接受更多的信号输人:如果对一个基因的调控不仅仅发生在最开始的阶段, 那么就会有更多的信号来调控它的表达, 或者是同样的信号可以更加有效。
- 在后面的阶段调控可以减少反应的时间。
很多启动子通过协助RNA聚合酶结合DNA的活化子和阻遏两者结合的抑制子进行调控(转录前调控: 大多数启动子调控)

组成型表达(constitutive expression): 是指在个体发育的任一阶段都能在大多数细胞中持续进行基因表达。其基因表达产物通常是对生命过程必须的或必不可少的, 一般只受启动序列或启动子与RNA聚合酶相互作用的影响, 且较少受环境影响及其他机制调节, 因此也称为本底表达。
转录前抑制方式:
操作子(operator): 抑制子控制从某一启动子起始的表达, 只需结合到与聚合酶结合区相重叠的位点上, 阻碍聚合酶结合到启动子上从而阻止转录。这一位于DNA上抑制子结合的位点称为操作子。
转录前激活方式: 活化子以其一个表面结合到启动子附近的某一DNA位点;同时, 以另一表面与RNA聚合酶相互作用, 将聚合酶带到启动子。这一机制常被称为募集(recruitment), 这是一个蛋白质协同结合DNA(cooperative binding of proteins to DNA)的例子。
某些激活因子和抑制因子通过变构和调控RNA聚合酶对结合后的转录步骤起作用(转录后调控: 其他启动子调控)

从其他类型的启动子来考虑: 在这种情况下, RNA聚合酶不需协助就有效地结合在DNA上并形成稳定的封闭复合体。但是这一封闭复合体却不会自动转变成开放复合体(从而导致无转录或低水平转录)。在这一启动子上, 激活因子必须刺激闭合复合体转变为开放复合体。
刺激这类启动子的激活因子通过触发RNA聚合酶或DNA的构象改变起作用;也就是说, 它们与稳定的封闭复合体相互作用诱导发生构象改变, 引起封闭到开放复合体的转变。这一机制就是变构(allostery)的一个例证。
两个转录激活因子变构调节的例子。例如glnA启动子, 激活因子(NtrC)与在启动子上结合的封闭复合体中的RNA聚合酶相互作用, 刺激其转变为开放复合体。另一个例子(merT启动子)中, 激活因子(MerR)却是通过诱导启动子DNA的构象改变达成同一效果的。而在另外一类启动子中, 在启动子脱离这一步限制了转录激活。这类启动子的例子是malT基因的表达。在缺乏激活因子的时候, 起始会失败, 只有当存在激活因子的时候, 才可以有效地进入延伸阶段。
抑制子功能:
- 阻止RNA聚合酶的结合;
- 有些抑制因子可以在启动子处和聚合酶发生相互作用, 从而抑制向开放复合体的转化或者启动子脱离。
远程激活和DNA环化

有些互作蛋白质的结合位点在 DNA 上相距较远。在这种情况下,为了使蛋白质相互作用,结合位点之间的 DNA 就会形成环,让蛋白质结合位点彼此靠近。

远距离 DNA 位点的靠近是 DNA 链环化的方式之一:蛋白质在激活因子结合位点和启动子之间结合,使DNA 弯曲向有利的方向来协助激活因子和聚合酶相互作用。
协同结合和变构在基因调控中有很多作用
活化子的变构调节(Allostery regulation): 有时RNA pol可与启动子很好地结合, 但结合后不能自动转变为开放的起始复合物, 照样不能转录或转录很低。这时需要活化子与闭合复合物结合, 诱导RNApol或DNA promoter的构象变化, 使闭合复合物转变为开放复合物。这就是活化子的变构调节。
经常有成组的调控蛋白共同结合到DNA上, 即两个或多个活化子和(或)抑制子间彼此互作并与DNA相互作用, 彼此协助结合到所调控的基因附近。
- 敏感地接受外界的变化, 快速地启动基因的表达。
- 整合信号(integrate signal): 有些基因的激活需要多种信号的存在。
抗终止作用及其延续: 基因调控并不局限于转录起始调控
我们会看到几个细菌中基因调控的例子, 其中包括了转录延伸和终止水平中的调控。第20章(我们会谈到包括RNA调控在内的几个例子, 如衰减作用、核糖开关和小RNA)。一部分涉及转录的调控, 另一部分涉及翻译的调控。
抗终止的两种方式:
- 破坏终止位点RNA的茎-环结构
在一些控制氨基酸合成的操纵子结构基因前面有一段前导序列, 具有终止信号, 中间有串联的编码某一氨基酸的密码子。当介质中该氨基酸浓度较高时, 与此对应的氨酰tRNA含量也较高, 因此核糖体能够顺利通过串联密码子。在这种情况下, mRNA形成正常的二级结构, 其中包括末端的茎环结构, RNA聚合酶终止转录。当介质中该氨基酸浓度较低时, 缺乏相应的氨酰tRNA, 致使核糖体滞留再串联密码子上, mRNA不能形成特定的二级结构, 端粒的茎环结构被破坏, 因此转录仍然能进行下去, 出现转录的抗终止现象。 - 依赖于蛋白质因子的转录抗终止
λ噬菌体中由N基因编码产生的N蛋白具有抗终止作用, 但是其功能的发挥依赖于宿主所产生的NusA、NusB、S10等几种蛋白, 这些蛋白结合到终止子附近的DNA位点是实现抗转录终止的必要条件, N蛋白的识别B区转录形成的茎环结构并与之结合。NusA以二聚体的形式存在, 其一个亚基与RNA聚合酶结合, 另一个亚基与N蛋白结合。当其他蛋白都结合到该DNA位点时, 便形成了一个蛋白质复合物。并通过NusA与RNA聚合酶相结合, 改变聚合酶的构象, 使之对终止信号敏感, 继续催化RNA链的合成。
转录起始的调控:原核生物的实例
操纵子的概念(记得与操作子区分)
操纵子(operon): 是指原核生物中由一个或多个相关基因以及转录翻译调控元件组成的基因表达单元。操纵子通常由3个部分组成: 结构基因、调控元件、调节基因。
- 结构基因: 编码与某一代谢过程相关的酶类, 这些基因的表达受到协同控制。
- 调控元件(control elements): 例如操作子(operator)序列。
- 调节基因(Regulator gene): 编码与调控元件结合的蛋白质。(调节基因有时不在本身操纵子中编码, 而存在其他的操纵子中)。
乳糖操纵子(The lactose Operon)
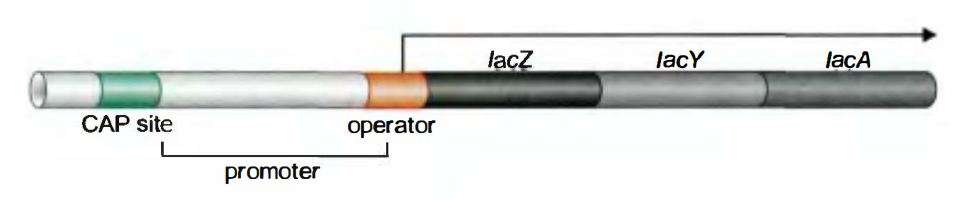
转录时, RNA聚合酶首先与启动区结合, 通过操纵区向右转录。转录从O区中间开始, 按lacZ→lacY→lacA方向进行, 每次转录出来一条mRNA上都带有这三个基因。这一mRNA白质产物。
乳糖操纵子的结构:
lacZ基因编码β-半乳糖苷酶, 该酶可将乳糖切割成半乳糖和葡萄糖, 后两种糖均可用作细胞的能量。
lacY基因编码乳糖透过酶, 该蛋白质插入细胞膜可以将乳糖转运到细胞内。
lacA基因编码硫代半乳糖苷转乙酰酶, 它可以消除同时被lacY转入的硫代半乳糖苷对细胞造成的毒性。
lacZYA转录单位含有一个操纵序列(Olac), 与Plac启动子有重叠, 可被位于Plac上游的调节基因lac I编码的阻遏蛋白结合。
正调控机制
CAP(cAMP受体蛋白)是一活化子, 通过与cAMP结合而被激活, 与启动子上游的CAP结合位点结合, 通过与RNA聚合酶α亚基的CTD作用, 招募RNA聚合酶到启动子上激活转录。
CAP活性的调控: 由于Plac没有UP元件, 因此在没有CAP时, RNA聚合酶与启动子结合能力也较低, 只能以低效率进行转录, 加入CAP时, 转录以高水平进行。葡萄糖降低细胞内cAMP的浓度, 这一分子是CAP的变构因子:只有当CAP与cAMP形成复合物时, CAP蛋白才会形成结合DNA的构象。因此, 只有当葡萄糖水平低(而cAMP水平高)时, CAP才会结合DNA,激活lac基因。CAP蛋白结合cAMP的部分与蛋白质结合DNA的部分是分开的。
负调控机制
当无乳糖存在时, lac I编码的阻遏蛋白以四聚体的形式发挥作用, 其中的两个阻遏蛋白单体与lacO的两个半位点结合, 由于Olac与Plac有重叠, Lac抑制因子结合到DNA上时, RNA聚合酶便无法结合到P位点上, 不能起始转录。但即便在环境中无乳糖, RNA聚合酶也能以较低的频率取代Lac抑制因子结合到启动子上, 起始转录, 即渗透表达, 这也是细胞中含有微量乳糖代谢酶的原因。
当有乳糖存在时, 乳糖被细胞内微量的β-半乳糖苷酶转变为异乳糖, 异乳糖作为lac基因的直接诱导物结合Lac抑制因子, 从而改变Lac抑制因子的构象, 使抑制因子不能结合Olac。此时RNA聚合酶可以结合起始lacZYA转录。
不同生长条件下的调节:
- 有葡萄糖, 有乳糖: 没有CAP结合, 也没有Lac抑制因子结合, 维持lac基因的本底水平表达;
- 有葡萄糖, 无乳糖: 没有CAP结合有Lac抑制因子结合, 基因无转录;
- 无葡萄糖, 有乳糖: 有CAP结合, 没有Lac抑制因子结合, 从而实现高水平转录。
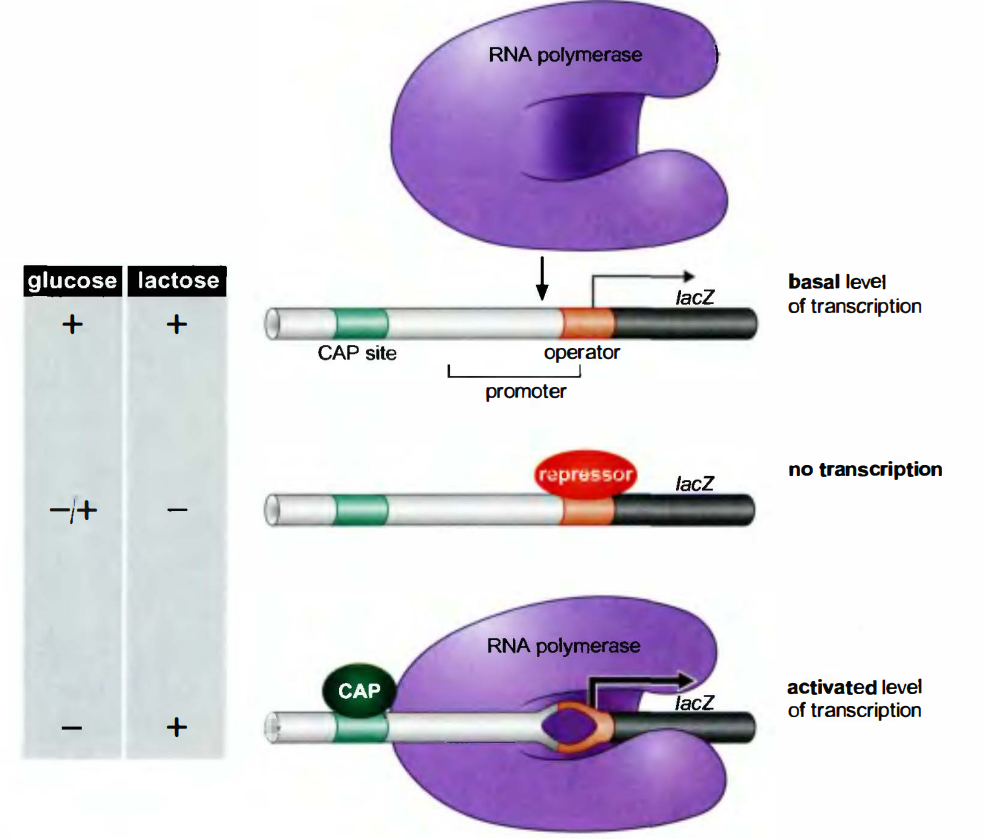
选择性的σ因子
选择性的σ因子(alternative σ factor): 不同的σ因子与同一种RNA pol结合, σ因子决定了RNApol与启动子结合特异性(promoter specificity)。
许多细菌可产生一系列σ因子, 分别用于正常和极端生长条件下的转录调控:
热激(Heat shock)反应:
E.coli在温度达37$^\circC$以上时, 表达大约17种热激特有蛋白。
选择因子中有一种热激σ因子——σ32。当E.coli受到热激时, 细胞中这种新σ因子的量就会升高, 它会取代RNA聚合酶上的σ7,指导酶转录那些产物会保护细胞免于受热激影响的基因。
噬菌体编码自己的σ因子:
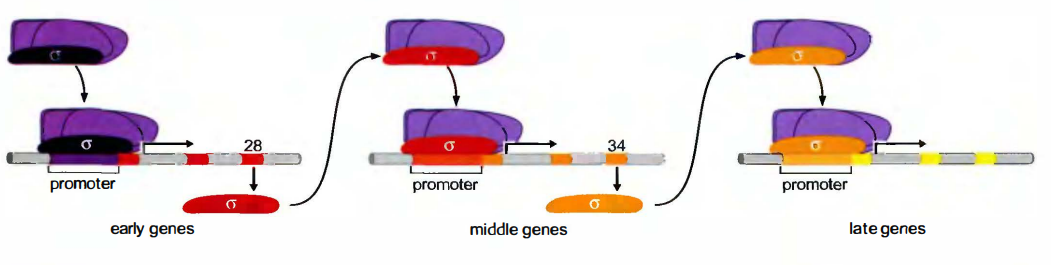
许多噬菌体(Bacteriophage)编码自己的σ因子, 利用宿主细菌的RNA pol, 选择地识别噬菌体基因启动子并表达这些基因。
一旦感染了噬菌体, 细菌RNA聚合酶(带有B. subtilis的σ70)就识别被称为”早期”的噬菌体启动子, 指导转录编码感染早期所需蛋白质的基因。
其中就有一个基因(称为基因28)编码个选择性σ。它取代了细菌的σ因子指导聚合酶结合到噬菌体基因组的第二套启动子上, 这些启动子与被称为”中期”的启动子相耦联。
而这些当中又包括一个编码σ因子的基因, 该σ因子又会指导转录噬菌体”晚期”基因。
NtrC和MerR:以变构而非募集发挥作用的转录激活因子
NtrC具有ATPase活性, 利用变构作用促使开放起始复合物的形成
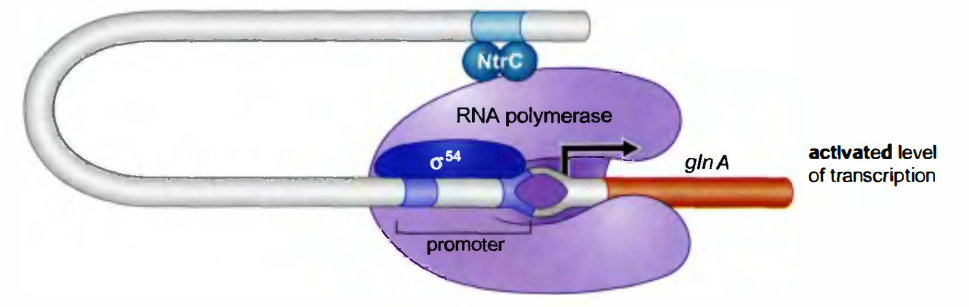
NtrC调控与氮代谢有关基因的表达, 如glnA基因。NtrC具有DNA结合和激活两个结构域(domain)。
转录glnA基因的RNA聚合酶的组成包括σ54亚基。在没有NtrC时, 这一聚合酶就结合到gln4启动子上, 形成稳定的封闭复合物。
NtrC的调控方式:
只有在氮浓度很低时, 激酶NtrB才将NtrC磷酸化, 使NtrC构象发生变化, 暴露其DNA结合域。一旦具有了活性, NtrC就会结合位于启动子上游150bp处的4个位点(在glnA基因上)。每一个位点都结合一个NtrC二聚体, 这些聚体通过蛋白质-蛋白质相互作用以高度协同的方式结合到4个位点上, 然后激活因子结合位点和启动子之间的DNA形成一个环。
NtrC与σ54直接作用, 再利用自身ATPase活性水解ATP获取能量, 将闭合的复合物转变为开放的复合物, 激活转录。
MerR通过扭曲启动子DNA而激活基因的转录
MerR控制抗汞酶基因merT的转录。
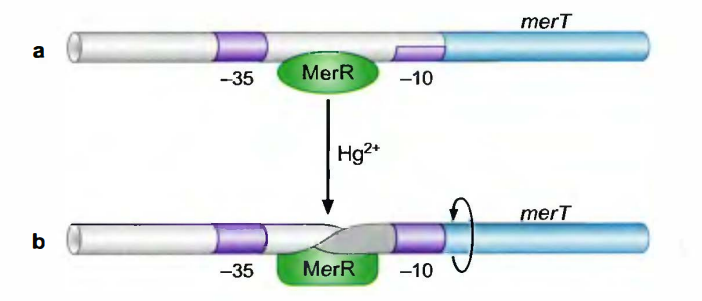
merT启动子不同于一般的启动子, 其-9与-35元件之间的距离是19bp而非σ70启动子中常见的15~17bp。这样将导致这两个被σ识别的序列元件既不能适当地间隔, 也不能平行排列, 这两者绕螺旋面彼此相向。
MerR调控方式:
当环境中无汞(mercury)时, MerR与merT启动子﹣10~﹣35间的一段DNA结合;聚合酶能与启动子结合, 但无法起始转录, 因此这种情况下无本底转录。
当汞与MerR结合时, MerR构象变化, 使所结合的DNA扭曲, 扭曲使merT启动子﹣10~﹣35形成类似强启动子的结构, 聚合酶可以起始merT的表达。
变构激活:
多数活化子通过募集RNA pol到启动子位点的方式发挥作用, 如CAP和选择性σ因子。
NtrC和MerR通过变构激活(allosteric activation)的方式发挥作用: 即这些转录活化子通过DNA或蛋白质的构象变化, 使已经形成的闭合起始复合物转变为开放起始复合物。
没有NtrC和MerR的参与, RNA pol可与启动子结合, 但形成没有活性的闭合起始复合物。
NtrC活化子是因为自身的构象变化才能暴露出DNA结合域, 与DNA结合, 并利用ATPase活性使闭合复合物转变为开放复合物。
MerR活化子导致DNA构象变化, 从而使闭合复合物转变为开放复合物。
抑制子以多种方式发挥表达调控作用
- Lac抑制因子以最简单的方式作用:通过结合与启动子有重叠区的位点, 阻碍了RNA聚合酶的结合。许多抑制因子也是以同样方式作用的。
- 有些抑制因子的结合位点不与启动子有重叠区。这些启动子不阻碍聚合酶的结合而是结合到启动子旁的位点, 与结合在启动子上的聚合酶相互作用, 抑制转录起始。(例如, E.coli的Gal抑制因子就是一个这样的例子。Gal抑制因子控制编码参与半乳糖代谢的酶的基因。在没有半乳糖的时候, 抑制因子保持基因不表达。在这种情况下, 抑制因子与聚合酶相互作用, 抑制封闭复合物到开放复合物的转变。)(另一个例子来自在细菌B.subtilis的噬菌体(中29)的P4蛋白。这一调控因子结合到一个弱化的启动子PA3的附近,与聚合酶相互作用作为一个激活因子, 它与aCTD相互作用, 与CAP相同。但这个激活因子还结合另一个称为PA2c强启动子。与在弱启动子上一样, 该调控蛋白也与聚合酶接触, 但在这里却是导致抑制。在前一种情况下额外的结合能协助募集聚合酶, 因此激活基因;而在后一种情况下, 由聚合酶和启动子之间的强相互作用加上激活因子相互作用所提供的总结合能太强, 以至于聚合酶无法从启动子上脱离。)
araBAD操纵子
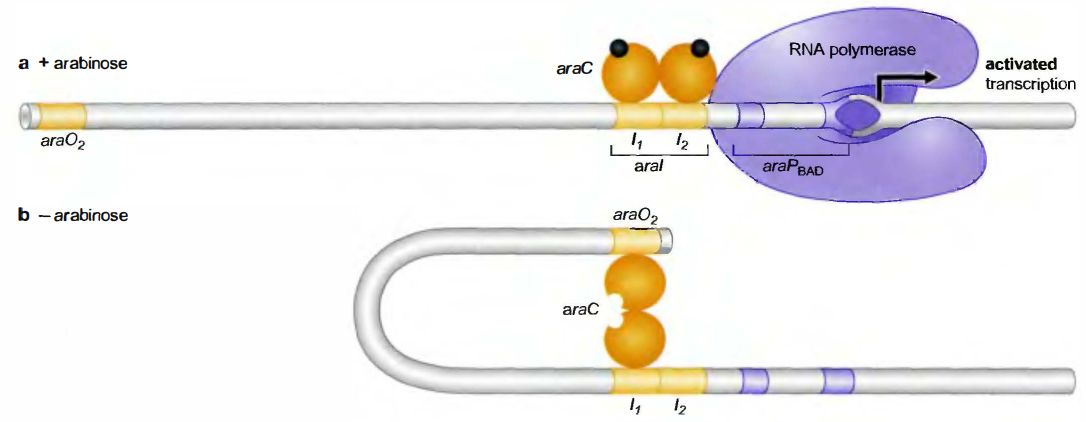
E.coli的araBAD操纵子的启动子在阿拉伯糖存在而没有葡萄糖时被激活, 指导编码阿拉伯糖代谢需要的酶的基因表达。有两个激活因子一起作用: AraC和CAP。
araBAD操纵子调控方式:
当存在阿拉伯糖时, AraC与阿拉伯糖结合, 形成可以结合DNA的构象, AraC以二聚体结合到紧邻的两个半位点——araI1和araI2。在这两个位点的上游就是一个CAP位点:无葡萄糖时, CAP结合到这里并协助激活转录。
没有阿拉伯糖时, araBAD基因不表达。AraC在不结合阿拉伯糖时, 会采取不同的构象以不同的方式结合DNA:一个单体仍结合aral位点, 但另个单体则结合远处一个叫araO2的半位点。由于这两个半位点相距194bp, 所以当AraC以这种方式结合上去时, 两个位点之间的DNA就会形成环。这样结合, aral2上没有AraC结合, 而启动子araBAD又是从这一位置被介导激活, 所以这样的构型不会激活启动子。
araBAD启动子常被用于表达载体:
阿拉伯糖对araBAD启动子的诱导活化非常强大, 因此, araBAD启动子常被应用于表达载体(expressionvector)。
将外源基因克隆在该启动子之后, 当受到阿拉伯糖的诱导时, 启动外源基因的高效表达。
以某基因与araBAD融合就可以使这一基因的表达由阿拉伯糖来控制: 该基因可以一直处于关闭状态, 除非想要其表达;如果想要其产物, 只需加入阿拉伯糖诱导即可。这样, 即使其产物对细菌细胞具有毒性, 也会进行表达。
色氨酸操纵子(the tryptophan operon)(第二十章)
衰减作用(attenuation): 因为色氨酸浓度降低, 抑制子不能得到辅阻遏物(即色氨酸)的协助, Trp操纵子的转录得以起始(第一层次的表达调控);随着色氨酸浓度的升高, Trp操纵子通过提前终止转录的方式抑制转录, 这种调控叫衰减作用。
色氨酸操纵子的结构:
色氨酸的操纵子是一种阻碍型操纵子, 它由5个结构基因构成: trpE、trpD、trpC、trpB、trpA, 调控位点靠近trpE, 它由下列成分构成: 一个启动子位点(trpP), 一个重叠的操纵基因位点(trpO)和一个前导区域trpC, 它编码一个前导肽和一个RNA衰减子。
trp操纵子的转录调控包括阻遏系统和弱化系统
阻遏系统(粗调):
trpP基因突变常引起trpmRNA的组成型合成, 改基因产物因此称为辅阻遏蛋白, 辅阻遏蛋白与色氨酸相结合成有活性的阻遏物, 该系统中的效应物是色氨酸, 它是trp操纵子所编码的生物合成途径的末端最终产物。当培养基中色氨酸含量较高时, 它与游离辅阻遏蛋白相结合, 并使之与操纵区DNA紧密结合, 遏制基因转录;当培养基中色氨酸供应不足时, 辅阻遏物失去色氨酸并从操纵区上解离, trp操纵子去阻遏, 开始转录。
前导肽(leader): 色氨酸操纵子RNA的前导序列中含有一个有效的核糖体结合位点, 并能产生一个含有14个aa的多肽, 这个多肽被称为前导肽。在前导序列的第10和第11位上有相邻的两个trp密码子, 参与操纵子中的转录弱化机制。
弱化系统(衰减作用)(细调):
当培养基中色胺酸浓度低时, 负载有色氨酸的tRNAtrp就少, 这样翻译通过两个相邻trp密码子的速度就会很慢, 当4区被转录完成时, 核糖体才进行到1区, 这时的前导区结构是2-3配对, 不形成3-4配对的终止结构, 转录持续进行, 操纵子转录成一个全长mRNA(通读)。
当培养基中的色氨酸浓度较高时, 核糖体顺利通过两个相邻的色氨酸密码子, 在4区, 被转录之前就到达2区, 3-4区自由的配对形成茎-环状终止子结构, 转录提前停止, 操纵子转录成前导RNA(139nt)。
λ噬菌体:调控的层次
细菌噬菌体λ是一种感染E. coli的病毒。它一旦感染细菌, 就会以两种方式繁殖: 裂解(lytically)或溶原生长(lysogenically)。
裂解生长需要噬菌体DNA的复制和新的外壳蛋白的合成。这些组分共同形成新的噬菌体颗粒, 通过宿主细胞的裂解释放出来。
溶原现象: 一种选择性繁殖途径, 包括噬菌体DNA整合进入细菌染色体并像细菌基因组的正常组分似的在每次细胞分裂的时候主动复制。
溶原性诱导(lysogenic induction): 溶原性细菌在正常情况下非常稳定, 但其体内处于静止的噬菌体(原噬菌体, prophage)在细胞DNA遭受破坏时就会有效地转向裂解生长(因此会威胁到宿主细胞的继续生存)。这种从溶原性生长到裂解生长的转变称为溶原性诱导。
基因表达的选择性模式控制裂解和溶原性生长
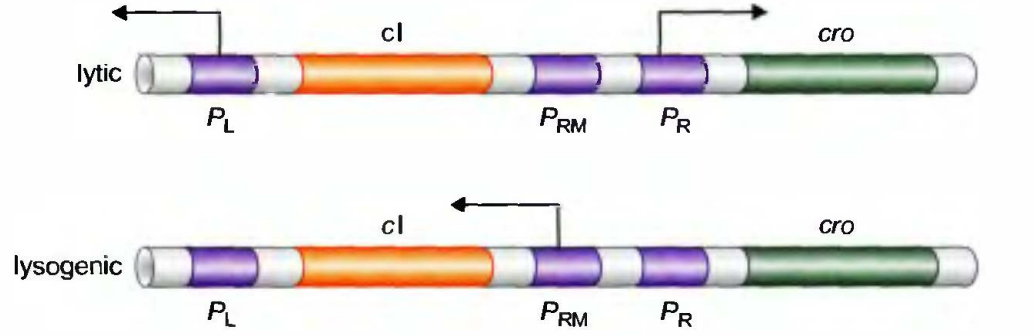
当PR和PL持续开放而PRM关闭时, 就发生裂解生长。相反, 溶原生长则是PR和PL关闭而PRM打开的结果。
调控蛋白及其结合位点:
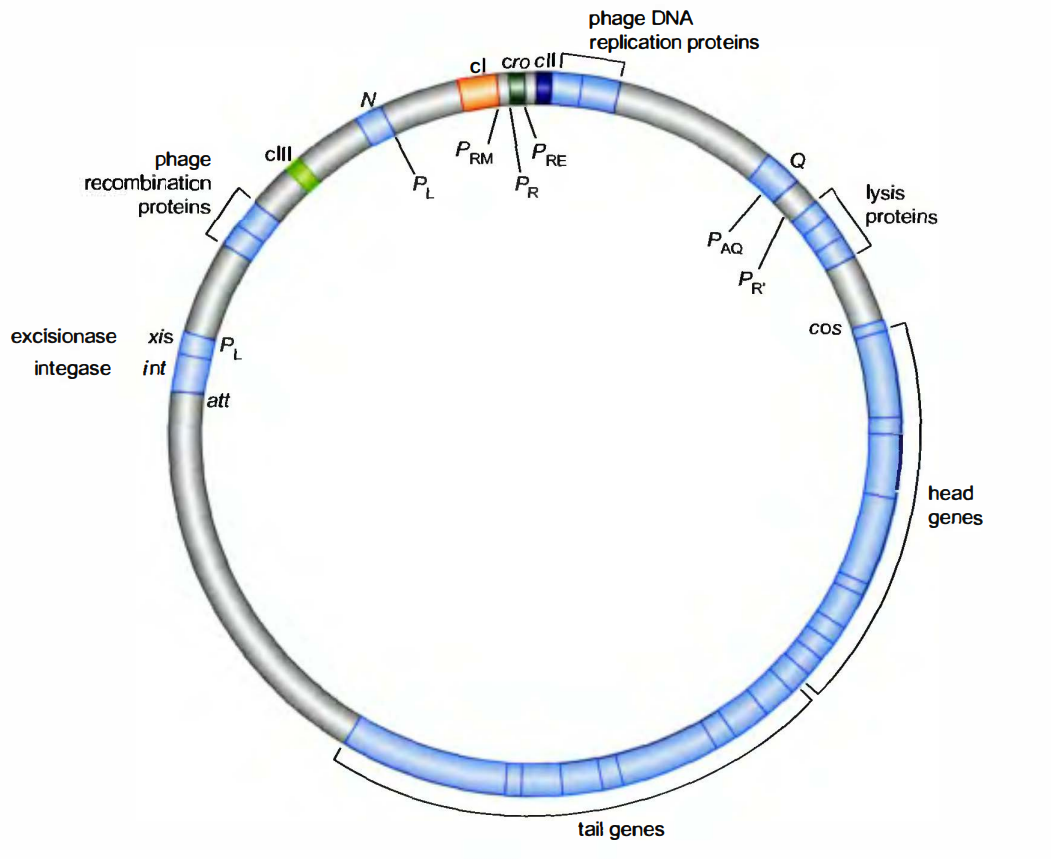
- cⅠ基因编码λ抑制子。λ抑制子既可以激活也可以抑制转录。
- Cro(意为抑制子和其他基因的控制, control of repressor and other thing)只抑制转录, 类似于Lac抑制子。
- λ抑制子和Cro可以结合6个操作子中的任意一个, 每个蛋白质以不同的亲和力识别这些位点, 3个位点位于左控制区, 3个位于右控制区。位于右侧操纵子的3个位点称为OR1、OR2和OR3;
- λ抑制子与操作子位点协同结合。
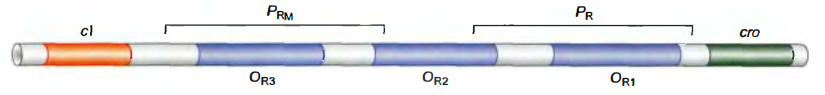
这些位点的序列相似, 每一个位点都可以结合一个抑制因子或者Cro二聚体, 其相互作用的亲和力是不一样的。抑制因子结合OR1是它结合OR2的亲和力的10倍, OR3结合抑制因子的亲和力与OR2的相同。Cro则相反, 其与OR3结合的亲和力最强, 而结合OR1和OR2则需10倍浓度。
裂解和溶源生长的调控机制
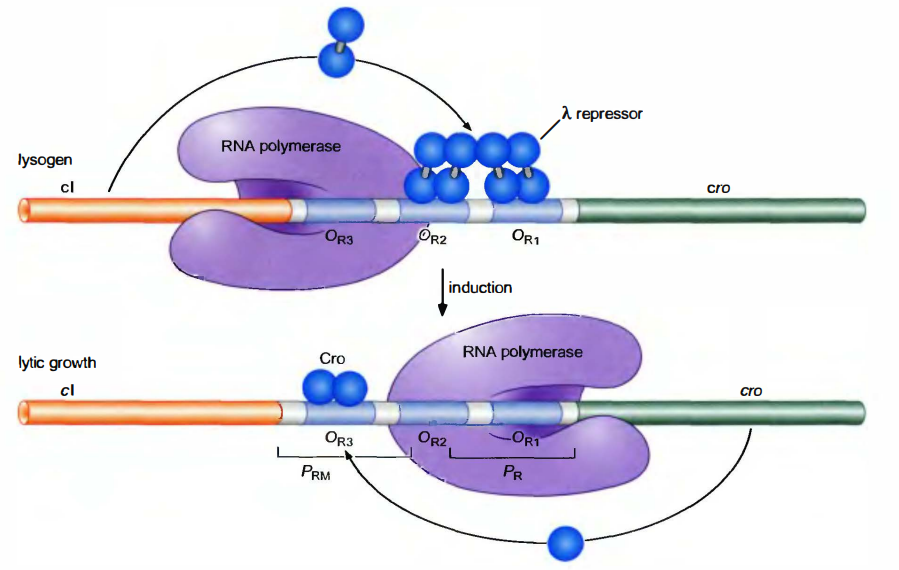
对裂解生长来说:单个Cro二聚体结合OR3, 这一位点与PRM重叠, 因此, Cro抑制了该启动子(这一启动子是弱启动子, 在无激活因子时只以低水平作用)。抑制因子和Cro都不与OR1和OR2结合, 因此PR结合RNA聚合酶并指导裂解基因的转录; PL作用方式与此相同。PR和PL都是无需激活因子的强启动子。
在溶原周期:PRM开放, 而PR和PL关闭。抑制因子协同结合到OR1和OR2阻碍RNA聚合酶结合PR,抑制从该启动子开始的转录, 但抑制因子的结合激活了从PRM开始的转录。
由溶原向裂解转变:如果细胞是溶原体, 原噬菌体就倾向于在胁迫环境下逃离细胞。λ抑制子也在RecA的作用下进行自身切割, 切割反应除去了抑制子的C端结构域, 因此二聚化和协同性马上不复存在。失去协同性使抑制子在这些位点(包括OL1和OL2)上解耦联;失去抑制从而促进了从PR和PL开始的转录, 导致了裂解生长。
溶原性λ抑制因子水平调控:
正自我调控(positive autoregulation): 为了有效诱导, 溶原性细胞中的抑制因子水平必须严密调控。抑制因子是保证其水平不致降得太低:激活其自身的表达。
负自我调控(negative autoregulation):PRM被抑制因子(在OR2处)激活合成更多的抑制因子。但如果浓度过高时, 抑制因子也会结合Ok3和抑制PRM(以类似于裂解生长中Cro结合OR3和抑制PRM的方式)。这样阻止了新的抑制因子的合成, 直到其浓度降到释放OR3的水平。
抑制子的负自我调控需远程相互作用和大的DNA环
OR3和OR2上结合的抑制子二聚体与协同结合到OL1和OL2上的抑制子二聚体相互作用, 形成一个抑制子八聚体;为利于OR和OL之间的抑制子的相互作用, 这些操作子之间的DNA——约3.5kb, 包括cⅠ基因本身, 必须形成一个环。当环形成时, OR3和OL3靠近, 允许另外两个二聚体抑制子协同结合到这两个位点。
λcII,一种控制溶原或裂解生长或感染新宿主的活化子
CII是一个转录活化子。它结合到启动子PRE上游的位点, 刺激从该启动子开始cI(抑制子)基因的转录。
PRE是一个弱启动子, 因为它有一个不完全的-35序列。C II蛋白在背对DNA螺旋的一面结合到与-35区有重叠的位点;通过与聚合酶直接作用, C II协助聚合酶结合到启动子上。只有PRE产生出足够的抑制因子, 这一抑制因子才可以结合到OR1和OR2指导其自身从PRM开始的合成。抑制因子合成是从一个启动子转录来确立(由一个激活因子激活),接着由另一个启动子维持(通过抑制因子自身控制——正自我调控)。
C II是如何指挥λ在裂解和溶原发育途径中做出选择的?
一经感染, 从PR和PL两个组成型启动子开始的转录就会立即起始。PR指导合成Cro和CII。Cro的表达使噬菌体进入裂解发育:一旦Cro达到一定的水平, 它就会结合OR3封闭PRM。另一方面, CII的表达则通过指导抑制因子基因的转录使噬菌体进入溶原性生长。为了成功地形成溶原性细胞, 抑制因子必须在Cro抑制启动子之前结合OR1和OR2并激活PRM。C II决定的C I基因的转录效率, 即抑制因子产生的速率, 是决定入如何发展的关键步骤。
什么决定了C II工作的效率呢?
E. Coli的生长条件控制CⅡ的稳定性并因而控制裂解/溶原的选择: CⅡ在E. coli中是一个非常稳定的蛋白质, 它被一个特异的蛋白酶FtsH(HflB)降解, 这个酶由hfl基因编码。
当生长良好时, FtsH活性高, CⅡ被有效破坏, 抑制子不能合成, 噬菌体倾向于裂解生长;在恶劣条件下则相反, FtsH活性低, CⅡ降解慢, 抑制子积累, 噬菌体倾向于溶原生长。
逆回调控: RNA合成和稳定性控制相互影响并决定基因表达
逆向调控(retroregulation): 负责负调控的位点位于它所影响的基因的下游, 同时降解是沿着基因逆向进行的, 所以这一过程称为逆向调控。
考点补充
名词补充