细胞生物学 第十一章 细胞信号传导
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18 ____ ___ ___ ____ ___
/\ _`\ /\_ \ /\_ \ /\ _`\ __ /\_ \
\ \ \/\_\ __\//\ \ \//\ \ \ \,\L\_\/\_\ __ ___ __ \//\ \
\ \ \/_/_ /'__`\\ \ \ \ \ \ \/_\__ \\/\ \ /'_ `\ /' _ `\ /'__`\ \ \ \
\ \ \L\ \/\ __/ \_\ \_ \_\ \_ /\ \L\ \ \ \/\ \L\ \/\ \/\ \/\ \L\.\_ \_\ \_
\ \____/\ \____\/\____\/\____\ \ `\____\ \_\ \____ \ \_\ \_\ \__/.\_\/\____\
\/___/ \/____/\/____/\/____/ \/_____/\/_/\/___L\ \/_/\/_/\/__/\/_/\/____/
/\____/
\_/__/
______ __ __
/\__ _\ /\ \ /\ \__ __
\/_/\ \/ _ __ __ ___ ____ \_\ \ __ __ ___\ \ ,_\/\_\ ___ ___
\ \ \/\`'__\/'__`\ /' _ `\ /',__\ /'_` \/\ \/\ \ /'___\ \ \/\/\ \ / __`\ /' _ `\
\ \ \ \ \//\ \L\.\_/\ \/\ \/\__, `\/\ \L\ \ \ \_\ \/\ \__/\ \ \_\ \ \/\ \L\ \/\ \/\ \
\ \_\ \_\\ \__/.\_\ \_\ \_\/\____/\ \___,_\ \____/\ \____\\ \__\\ \_\ \____/\ \_\ \_\
\/_/\/_/ \/__/\/_/\/_/\/_/\/___/ \/__,_ /\/___/ \/____/ \/__/ \/_/\/___/ \/_/\/_/
细胞信号转导概述
细胞通讯(cell communication): 是指一个信号产生细胞发出的信息通过介质(又称配体)传递到另一个靶细胞并与其相应的受体相互作用, 然后通过细胞信号转导产生靶细胞内一系列生理生化变化, 最终表现为靶细胞整体的生物学效应的过程。
信号转导(signal transduction): 是指信号的识别、转移与转换, 包括配体与受体的结合、第二信使的产生及其后的级联反应等。信号转导强调信号的接收与接收后信号转换的方式与结果。
细胞通讯
细胞通讯的方式:
细胞Mk过分泌化学信号进行细胞间通讯, 这是多细胞生物普遍采用的通讯方式, 细胞分泌化学信号可长距离或短距离发挥作用, 其作用方式分为:
- 内分泌(endocrine): 由内分泌细胞分泌信号分子(如激素)到血液中, 通过血液循环运送到体内各个部位, 作用于靶细胞。
- 旁分泌(paracrine): 细胞通过分泌局部化学介质到细胞外液中, 经过局部扩散作用于邻近靶细胞, 在多细胞生物中调节发育的许多生长因子往往是通过短距离而起作用的。此外, 旁分泌方式对创伤或感染组织刺激细胞增殖以恢复功能也具有重要意义。
- 通过化学突触传递神经信号, 从作用范围来讲, 属短距离局部作用, 当神经元接受刺激后, 神经信号以动作电位的形式沿轴突快速传递至神经末梢, 电压门控的Ca2+通道将电信号转换为化学信号, 即刺激突触前化学信号(神经递质或神经肽)小泡的分泌, 化学信号通过扩散到达突触后膜, 再通过后膜上配体门控通道将化学信号转换回电信号, 实现电信号-化学信号-电信号的快速转导。
- 自分泌(autocrine): 细胞对自身分泌的信号分子产生反应。自分泌信号常存在于病理条件下, 如肿瘤细胞合成并释放生长因子刺激细胞自身, 导致肿瘤细胞的增殖
- 细胞间接触依赖性通讯(contact-dependent signaling): 细胞间直接接触而无需信号分子的释放, 通过信号细胞质膜上的信号分子与靶细胞质膜上的受体分子相互作用来介导细胞间的通讯。这种通讯方式包括细胞-细胞黏着、细胞-基质黏着, 这种接触依赖性通讯在胚胎发育过程中对组织内相邻细胞的分化命运具有决定性影响。
- 动物相邻细胞间形成间隙连接、植物细胞间通过胞间连丝使细胞间相互沟通, 通过交换小分子来实现代谢偶联或电偶联, 从而实现功能调控。
胞外信号所介导的细胞通讯步骤:
- 信号细胞合成并释放信号分子;
- 转运信号分子至靶细胞;
- 信号分子与靶细胞表面受体特异性结合并导致受体激活;
- 活化受体启动靶细胞内一种或多种信号转导途径;
- 引发细胞代谢、功能或基因表达的改变;
- 信号的解除并导致细胞反应终止。
信号分子与受体
信号分子
信号分子(signal moleculer): 是细胞的信息载体, 能与膜受体或胞浆受体结合、相互作用并产生特定生物学效应的物质, 包括化学信号诸如各类激素、局部介质和神经递质等, 以及物理信号诸如声、光、电和温度变化等。化学信号可分为亲水性、亲脂性、气体三类。
各种化学信号根据其化学性质通常可分为3类:
- 气体性信号分子: 包括NO、CO, 可以自由扩散, 进入细胞直接激活效应酶(鸟苷酸环化酶)产生第二信使cGMP, 参与体内众多的生理过程, 影响细胞行为。
- 疏水性信号分子: 主要是甾类激素和甲状腺素, 是血液中长效信号,这类亲脂性分子小、疏水性强, 可穿过细胞质膜进入细胞, 与细胞内核受体结合形成激素-受体复合物, 调节基因表达。
- 亲水性信号分子: 包括神经递质、局部介质和大多数蛋白类激素, 它们不能透过靶细胞质膜, 只能通过与靶细胞表面受体结合, 经信号转换机制, 在细胞内产生第二信使或激活蛋白激酶或蛋白磷酸酶的活性, 引起细胞的应答反应。
受体
受体(receptor): 是一类能够识别和选择性结合某种配体(信号分子)的大分子, 绝大多数受体都是糖蛋白, 一般至少包括两个功能区域, 与配体结合的区域和产生效应的区域, 当受体与配体结合后, 构象改变而产生活性, 启动一系列过程, 最终表现为生物学效应。根据靶细胞上受体存在的部位, 可将受体区分为细胞内受体和细胞表面受体。
细胞内受体(intracellular receptor): 位于胞质溶胶、核基质中的受体称为细胞内受体。细胞内受体通常有两个不同的结构域, 一个是与DNA结合的中间结构域, 另一个是激活基因转录的N端结构域, 细胞内受体的基本结构都很相似,有极大的同源性。细胞内受体主要是同脂溶性的小信号分子相作用, 位于胞质中受体要与相应的配体结合后才可进入细胞核, 从而影响基因转录。
细胞表面受体(surface receptor): 位于细胞质膜上的受体称为表面受体,表面受体多为膜上的功能性糖蛋白, 主要被相应的信号分子所识别, 并与之结合, 将外部信号转变成内部信号, 以启动一系列反应而产生特定的生物效应。细胞表面受体根据信号转导机制和受体蛋白类型的不同, 细胞表面受体又分属三大家族:
- 离子通道偶联受体(ion channel-coupled receptor): 又称配体门离子通道(ligand-gatedchannel)或递质门离子通道(transmitter-gated channel)。具有离子通道作用的细胞质膜受体称为离子通道偶联受体, 这种受体常见于可兴奋细胞间的突出信号传导, 产生一种电效应。
- G蛋白偶联受体(G protein-coupled receptor,GPCR): G蛋白偶联受体都含有7个疏水肽段形成的跨膜a螺旋区和相似的三维结构, N端在细胞外侧, C端在细胞胞质侧。配体与受体结合后激活相邻的G-蛋白, 被激活的G-蛋白又可激活或抑制一种产生特异第二信使的酶或离子通道,引起膜电位的变化。由于这种受体参与的信号转导作用要与GTP结合的调节蛋白相偶联,因此将它称为G蛋白偶联受体。G蛋白是细胞表面受体中最大家族, 普遍存在于各类真核细胞表面, 根据其偶联效应蛋白的不同, 介导不同的信号通路。
- 酶联受体(enzyme-linked receptors): 酶联受体至少有两个功能域, 结合配体的功能域及产生效应的功能域, 分别具有结合特异性和效应特异性。并非所有的酶联受体的细胞内结构域都具有酶活性, 按照受体的细胞内结构域是否具有酶活性分为两大类:一类是受体胞内结构域具有潜在酶活性, 另一类是受体本身不具酶活性, 而是受体胞内段与酶相联系。这一类受体转导的信号通常与细胞的生长、繁殖、分化、生存有关。
细胞胞表面受体介导的调控细胞基因表达的信号通路, 反应机制和特征可分为四类:
- GPCR-cAMP-PKA和RTK-Ras-MAPK信号通路, 它们通过活化受体导致胞质蛋白激酶的活化, 活化的胞质激酶转位到核内并磷酸化特异的核内转录因子, 进而调控基因转录。
- TGF-B-Smad和JAK-STAT信号通路, 是通过配体与受体结合激活受体本身或偶联激酶的活性, 直接或间接导致胞质内特殊转录因子的活化, 进而影响核内基因的表达。
- Wnt受体和Hedgchog受体介导的信号通路是通过配体与受体结合引发胞质内多蛋白复合物去装配, 从而释放转录因子, 再转位到核内调控基因表达。
- NF-κB和Notch两种信号通路涉及到抑制物或受体本身的蛋白切割作用, 从而释放活化的转录因子, 再转位到核内调控基因表达。
4类信号通路的共同特点:
- 所介导的细胞反应是长期反应, 结果是改变核内基因的转录;
- 细胞外信号所诱导的长期反应影响多方面的细胞功能, 包括细胞增殖、细胞分化、细胞通讯, 在影响发育方面起关键作用,一并与许多人类疾病有关;
- 信号转导过程是高度受控的, 前三类信号调节通路往往是可逆的, 而第四类通路却是不可逆的过程。
受体结合特异性配体后而被激活,通过信号转导途径将胞外信号转换为胞内信号,引发两种主要的细胞反应:
- 细胞内预存蛋白活性或功能的改变,进而影响细胞代谢功能的短期反应(快反应);
- 影响细胞内特殊蛋白的表达量,最常见的方式是通过转录因子的修饰激活或抑制基因表达的长期反应(慢反应),最后的综合效应是改变细胞的行为。
受体与配体作用的复杂性:
- 不同细胞对同一种化学信号分子可能具有不同的受体, 不同的靶细胞以不同的方式应答于相同的化学信号;
- 不同的细胞具有相同的受体, 当与同一种信号分子结合时, 不同细胞对同一信号产生不同的反应;
- 同一细胞不同的受体应答于不同的胞外信号产生相同的效应;
- 一种细胞具有一套多种类型的受体, 应答多种不同的胞外信号从而启动细胞不同生物学效应, 靶细胞一是通过受体对信号结合的特异性, 二是通过细胞本身固有的特征对外界信号产生反应。
第二信使与分子开关
第二信使学说(second messenger theory): 即胞外化学信号(第一信使)不能进入细胞, 它作用于细胞表面受体, 导致产生胞内信号(第二信使), 从而引发靶细胞内一系列生化反应, 最后产生一定的生理效应, 第二信使的降解使其信号作用终止。
第二信使(second messenger): 是指在胞内产生的非蛋白类小分子, 通过其浓度变化(增加或减少)应答胞外信号与细胞表面受体的结合, 调节细胞内酶和非酶蛋白的活性, 从而在细胞信号转导途径中行使携带和放大信号的功能, 它们能够激活级联系统中酶的活性,以及非酶蛋白的活性。包括cAMP、cGMP、Ca2+等。第二信使也控制着细胞的增殖、分化和生存,并参与基因转录的调节。
分子开关(molecular switch): 在进化上保守的胞内蛋白, 细胞信号传递级联中, 通过结合GTP与水解GDP, 或者通过蛋白质磷酸化与去磷酸化而开启或关闭蛋白质的活性, 是具有关闭和开启信号传递功能的分子。其功能作用依赖于细胞外信号的刺激。主要有两类:
- GTPase分子开关调控蛋白构成的细胞内GTPase超家族, 包括三聚体GTP结合蛋白和单体GTP结合蛋白如Ras和类Ras蛋白。这类鸟苷酸结合蛋白当结合GTP时呈活化的”开启”状态, 当结合GDP时呈失活的”关闭”状态。开关调控蛋白通过两种状态的转换控制下游靶蛋白的活性。
- 更为普遍存在的分子开关机制, 是通过蛋白激酶使靶蛋白磷酸化, 通过蛋白磷酸水解酶使靶蛋白去磷酸化, 从而调节靶蛋白的活性蛋白质磷酸化和去磷酸化可为细胞提供一种”开关”机制, 使各种靶蛋白处于”开启”或”关闭”的状态。蛋白质磷酸化和去磷酸化可以改变蛋白质的电荷并改变蛋白质构象, 从而导致该蛋白质活性的增强或降低, 是细胞内普遍存在的一种调节机制, 在代谢调节、基因表达、细胞周期调控中具有重要作用。
蛋白激酶A(protein kinase A, PKA): 又称依赖于cAMP的蛋白激酶A, 是由四个亚基组成的四聚体,其中两个是调节亚基, 另两个是催化亚基。蛋白激酶A的功能是将ATP上的磷酸基团转移到特定蛋白质的丝氨酸或苏氨酸残基上进行磷酸化,被蛋白激酶磷酸化了的蛋白质可以调节靶蛋白的活性。真核细胞内几乎所有的cAMP的作用都是通过活化PKA,从而使其底物蛋白发生磷酸化而实现的。)
信号转导系统及其特性
信号转导系统的基本组成及信号蛋白的相互作用
细胞表面受体介导的信号通路步骤:
- 细胞表面受体特异性识别并结合胞外信号分子(配体),形成受体-配体复合物, 导致受体激活;
- 由于激活受体构象改变, 导致信号初级跨膜转导, 靶细胞内产生第二信使或活化的信号蛋白;
- 通过胞内第二信使或细胞内信号蛋白复合物的装配, 起始胞内信号放大的级联反应(signalingcascade);
- 细胞应答反应, 如果这种级联反应主要是通过酶的逐级激活, 结果将改变细胞代谢活性, 或者通过基因表达调控蛋白影响细胞基因表达和影响发育, 或者通过细胞骨架蛋白的修饰改变细胞形状或运动;
- 受体脱敏(desensitization)或受体下调(down-regulation), 终止或降低细胞反应。
$SH_2$结构域(Src homology 2 domain): 是研究蛋白质互作的原型模式结构域, 具有SH2结构域的蛋白家族, 具有相似的三维结构, 但每一成员可特异性结合围绕磷酸酪氨酸残基的氨基酸序列。该蛋白家族包括多种功能性成员:
- 酶, 含有一或两个与催化序列相联系的SH2结构域;
- 癌蛋白;
- 锚定蛋白(docking protein);
- 接头蛋白(adaptor)含单个SH2和多个SH3结构域;
- 调节蛋白(regulator)许多SH2蛋白家族成员具有调节功能;
- 转录因子。
细胞内信号蛋白复合物的装配
细胞内信号蛋白复合物的装配有3种策略:
- 细胞表面受体和某些细胞内信号蛋白通过与大的支架蛋白结合预先形成细胞内信号复合物, 当受体结合胞外信号被激活后, 再依次激活细胞内信号蛋白并向下游传递。
- 依赖激活的细胞表面受体装配细胞内信号蛋白复合物, 即表面受体结合胞外信号被激活后, 受体胞内段多个氨基酸残基位点发生自磷酸化作用, 为细胞内不同的信号蛋白提供锚定位点, 形成短暂的信号转导复合物分别介导可能不同的下游事件。
- 受体结合胞外信号被激活后, 在邻近质膜上形成修饰的肌醇磷脂分子, 从而募集具有PH结构域的信号蛋白, 装配形成信号复合物。
信号转导系统的主要特性
- 特异性(specificity): 细胞受体与胞外配体通过结构互补机制以非共价键结合, 形成受体-配体复合物, 简称具有”结合”特异性,受体因结合配体而改变构象被激活, 介导特定的细胞反应, 从而又表现出”效应器”特异性。
- 放大效应(amplification): 信号传递至胞内效应器蛋白(通常由酶或离子通道蛋白组成), 引发细胞内信号放大的级联反应。
- 网络化与反馈(feedback): 信号网络化效应有利于克服分子间相互作用的随机性对细胞生命活动的负面干扰。这样的网络特性是由一系列正反馈和负反馈环路组成的, 对于及时校正反应的速率和强度是最基本的调控机制。
- 整合作用(integration): 多细胞生物的每个细胞都处于细胞”社会”环境之中, 大量的信息以不同组合的方式调节细胞的行为。
信号通路: 细胞接受外界信号, 通过一整套特定机制, 将胞外信号转化为胞内信号, 最终调节特定基因表达, 引起细胞的应答反应, 这种反应系列称为细胞信号通路。
细胞内受体介导的信号传递
细胞内核受体及其对基因表达的调节
细胞内受体信号传递过程:
- 在细胞内, 受体与抑制性蛋白(如Hsp90)结合形成复合物, 处于非活化状态。
- 当信号分子(如皮质醇)与受体结合, 将导致抑制性蛋白从复合物上解离下来, 使受体暴露它的DNA结合位点而被激活。
- 这类信号分子与血清蛋白结合运输至靶组织并扩散跨越质膜进入细胞内, 通过核孔与特异性核受体结合形成激素-受体复合物并改变受体构象;激素-受体复合物与基因特殊调节区又称激素反应元件结合, 影响基因转录。
NO作为气体信号分子进入靶细胞直接与酶结合
NO的性质: NO是一种具有自由基性质的脂溶性气体分子, 可透过细胞膜快速扩散, 作用邻近靶细胞发挥作用。由于体内存在O2及其他与NO发生反应的化合物, NO在细胞外极不稳定, 只能在组织中局部扩散, 被氧化后以硝酸根(NO3)或亚硝酸根(NO2)的形式存在于细胞内外液中。血管内皮细胞和神经细胞是NO的生成细胞, NO的生成需要NO合酶的催化, 以L精氨酸为底物, 以还原型辅酶I(NADPH)作为电子供体,等物质的量地生成NO和L-瓜氨酸。
NO 作用机制:
- 血管神经末梢释放乙酰胆碱作用于血管内皮细胞G蛋白偶联受体并激活磷脂酶C, 通过第二信使IP3导致细胞质Ca2+水平升高。
- 当Ca2+结合钙调蛋白后, 刺激NO合酶催化精氨酸氧化形成瓜氨酸并释放NO,NO通过扩散进入邻近平滑肌细胞, 激活具有鸟苷酸环化酶活性的NO受体, 刺激生成第二信使cGMP。。
- cGMP通过cGMP依赖的蛋白激酶G的活化, 抑制肌动-肌球蛋白复合物信号通路, 导致血管平滑肌舒张。
G蛋白偶联受体介导的信号转导
G蛋白偶联受体的结构与激活
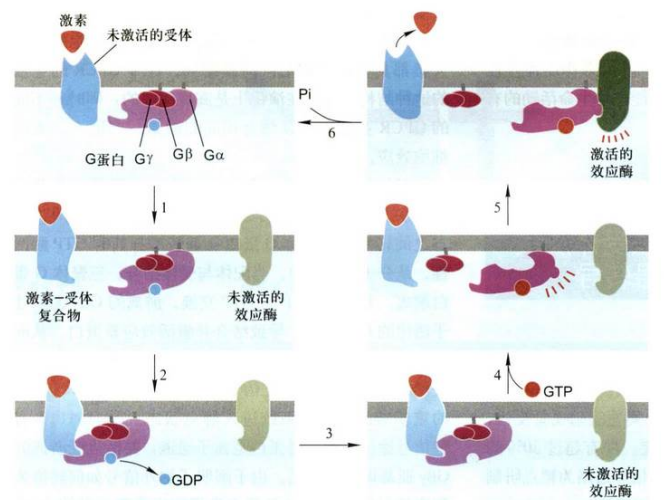
G蛋白(GTP binding protein): 是三聚体GTP结合调节蛋白的简称, 与GTP或GDP结合的蛋白质。G蛋白是由三个不同亚基组成,三个亚基分别是α、β、γ。β、γ两亚基通常以二聚体形式紧密结合在一起,Gα和Gβγ分别通过共价结合的脂分子锚定在质膜上,鸟苷结合位点位于α亚基上。此外,α亚基还具有GTPase的活性结构域和ADP核糖化位点。G蛋白参与细胞的多种生命活动,如细胞通讯、核糖体与内质网的结合、小泡运输、蛋白质合成等。
三聚体G蛋白解离活化的步骤如下:
- 配体(激素)结合诱发受体构象改变;
- 活化受体与Gα亚基结合;
- 活化的受体引发Gα亚基构象改变, 致使GDP与G蛋白解离;
- GTP与Gα亚基结合, 引发Gα亚基与受体和Gβγ亚基解离;
- 配体-受体复合物解离, Gα亚基结合并激活效应蛋白;
- GTP水解成GDP, 引发Gα亚基与效应蛋白解离并重新与Gβγ亚基结合, 恢复到三聚体G蛋白的静息状态。
G蛋白偶联受体所介导的细胞信号通路
由G蛋白偶联受体所介导的细胞信号通路按其效应器蛋白的不同, 可区分为3类
- 激活离子通道的G蛋白偶联受体;
- 激活或抑制腺苷酸环化酶,以CAMP为第二信使的G蛋白偶联受体;
- 激活磷脂酶C以IP3和DAG作为双信使的G蛋白偶联受体。
激活离子通道的G蛋白偶联受体所介导的信号通路
当受体与配体结合被激话后, 通过偶联G蛋白的分子开关作用, 调控跨膜离子通道的开启与关闭, 进而调节靶细胞的活性, 如心肌细胞的M乙酰胆碱受体和视杆细胞的光敏感受体, 都属于这类调节离子通道的G蛋白偶联受体。
- M乙酰胆碱受体在心肌细胞膜上与Gi蛋白偶联, 乙酰胆碱配体与受体结合使受体活化, 导致Giα亚基结合的GDP被GTP取代, 引发三聚体Gi蛋白解离, 使Gβγ亚基得以释放, 进而致使心肌细胞质膜上相关的效应器K+通道开启, 随即引发细胞内K+外流, 导致细胞膜超极化, 减缓心肌细胞的收缩频率。
- Gt蛋白偶联的光敏感受体的活化诱发cGMP门控阳离子通道的关闭
- 在暗适应状态下的视杆细胞, 高水平的第二信使cGMP保持cGMP门控非选择性阳离子通道的开放, 光的吸收产生激活的视蛋白O*;
- 活化的视蛋白与无活性的GDP- Gt三聚体蛋白结合并引发GDP被GTP置换;
- Gt三聚体蛋白解离形成游离的Gt。通过与cGMP磷酸二酯酶(PDE)抑制性γ亚基结合导致PDE活化;
- 同时引起γ亚基与催化性a和β解离, 由于抑制的解除, 催化性a和β亚基使cGMP转换成GMP;
- 由于胞质中cGMP水平降低导致cGMP从质膜cGMP门控阳离子通道上解离下来并致使阳离子通道关闭, 然后, 膜瞬间超极化。
激活或抑制腺苷酸环化酶的G蛋白偶联受体
不同的受体-配体复合物或者刺激或者抑制腺苷酸环化酶活性, 这类调控系统主要涉及5种蛋白组分:
- 刺激性激素的受体(Rs)
- 抑制性激素的受体(Ri)
- 刺激性G蛋白(Gs)
- 抑制性G蛋白(Gi)
- 腺苷酸环化酶(AC)。
刺激性与抑制性作用效果:
- 刺激性繳素与相应刺激性激素受体(Rs)结合, 偶联刺激性三聚体G蛋白(具刺激性Gα亚基, 即Gs), 刺激腺普酸环化酶活性, 提高靶细胞CAMP水平;
- 抑制性激素与相应抑制性激素受体(Ri)结合, 偶联抑制性三聚体G蛋白(与刺激性三聚体G蛋白含相同的Gβγ亚基, 不同的Gα亚基即抑制性Giα亚基), 结果抑制腺苷酸环化酶活性, 降低靶细胞CAMP水平。
cAMP-PKA 信号通路对肝细胞和肌细胞糖原代谢的调节
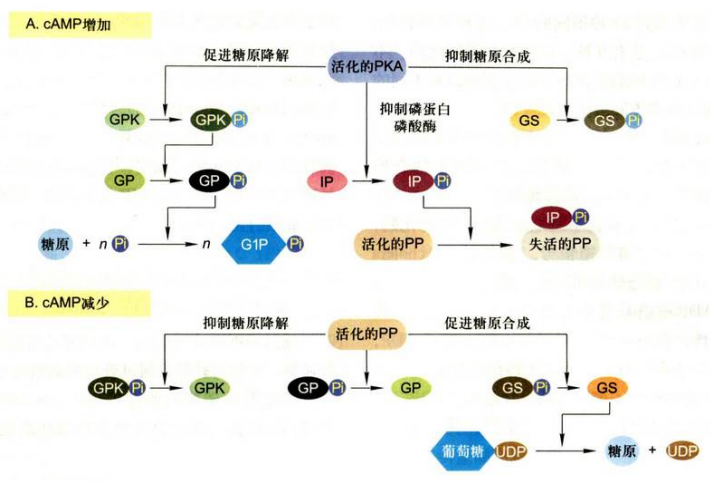
- 当细胞内cAMP水平增加时, cAMP依赖的PKA被活化, 活化的PKA首先磷酸化糖原磷酸化酶激酶(GPK),使其激活, 继而使糖原磷酸化酶(GP)被磷酸化而激活、活化的GP刺激糖原的降解, 生成葡糖-1-磷酸;另一方面, 活化的PKA使糖原合酶(GS)磷酸化, 抑制其糖原的合成。此外, 活化的PKA还可以使磷蛋白磷酸酶抑制蛋白(IP)磷酸化而被激活, 活化的IP与磷蛋白磷酸酶(PP)结合并使其磷酸化而失活;
- 当细胞内cAMP水平降低时, cAMP依赖的PKA活性下降, 致使磷蛋白磷酸酶抑制蛋白(IP)磷酸化过程逆转, 导致磷蛋白磷酸酶(PP)被活化。活化PP使糖原代谢中GPK和GP去磷酸化, 从而降低其活性, 导致糖原降解的抑制, 活化PP还促使GS去磷酸化, 结果GS活性增高, 从而促进糖原的合成。
cAMP-PKA 信号通路对真核细胞基因表达的调控
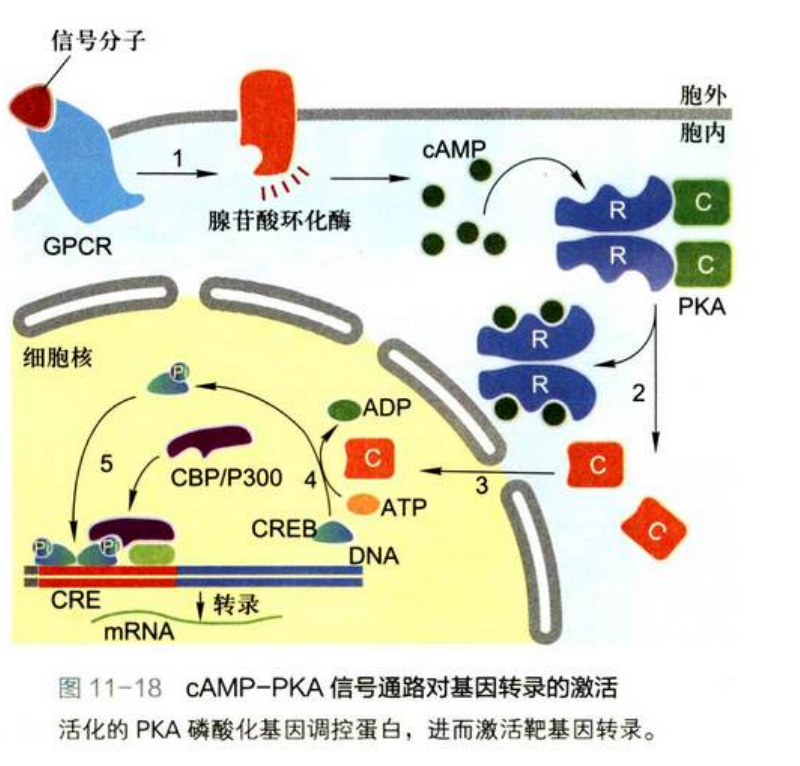
信号通路涉及的反应链表示:激素→G蛋白偶联受体→G蛋白→腺苷酸环化酶→cAMP→cAMP依赖的蛋白激酶A→基因调控蛋白→基因转录
具体步骤: 信号分子与受体结合通过Gα激活腺苷酸环化酶, 导致细胞内cAMP浓度增高, cAMP与PKA调节亚基结合, 导致催化亚基释放, 被活化的PKA其催化亚基转位进入细胞核, 使基因调控蛋白(CREB)磷酸化, 磷酸化的基因调控蛋白与核内CREB结合蛋白(CBP)特异结合形成复合物, 复合物与靶基因调控序列结合, 激活靶基因的表达。
霍乱的机理:
霍乱毒素(cholera toxin): 具有ADP-核糖转移酶活性, 进入细胞催化胞内的NAD+的ADP核糖基共价结合在Gsα亚基上, 致使Gsα亚基丧失GTP酶活性, 与Gsα亚基结合的GTP不能水解成GDP, 结果GTP永久结合在Gsα亚基上, 处于持续话化状态并不断地激活腺苷酸环化酶, 使腺苷酸环化酶被”锁定”在活化状态。霍乱病患者的症状是严重腹泻, 其主要原因就是霍乱毒素催化Gsα亚基ADP核糖基化, 致使小肠上皮细胞中cAMP水平增加100倍以上, 导致细胞大量Na+和水分子持续外流, 产生严重腹泻而脱水。
百日咳机理:
百日咳博德特氏菌(Bondetella pertussis): 产生百日咳毒素(pertussis toxin)催化Gi。亚基ADP-核糖基化, 结果防止与Gi。亚基结合的GDP的释放, 使Giα亚基被”锁定”在非话化状态, Giα亚基的失活导致气管上皮细胞内cAMP水平增高, 促使液体、电解质和黏液分泌减少。
激活磷脂酶C、以IP3和DAG作为双信使G蛋白偶联受体介导的信号通路
双信使IP3和DAG合成来源: 来自膜结合的磷脂酰肌醇(PI)。细胞膜结合的PI激酶将肌醇环上特定的羟基磷酸化,形成磷脂酰肌醇-4-磷酸(PIP)和磷脂酰肌醇-4,5-二磷酸(PIP2), 胞外信号分子与Go或Gq蛋白偶联的受体结合, 引起质膜上磷脂酶C的β异构体(PLCβ)的活化, 致便质膜上磷脂酰肌醇-4,5-二磷酸(PIP2)被水解生成IP,和DAG两个第二信使。IP3在细胞质中扩散;DAG是亲脂性分子, 锚定在膜上。
双信使系统(double messenger system): 以磷脂酰肌醇代谢为基础的信号通路的最大特点是胞外信号被膜受体接受后, 同时产生两个胞内信使, 分别激活两种不同的信号通路, 即IP3-Ca2+和DAG-PKC途径, 实现细胞对外界信号的应答, 把这种信号系统又称之为”双信使系统”。
双信号系统作用机制:
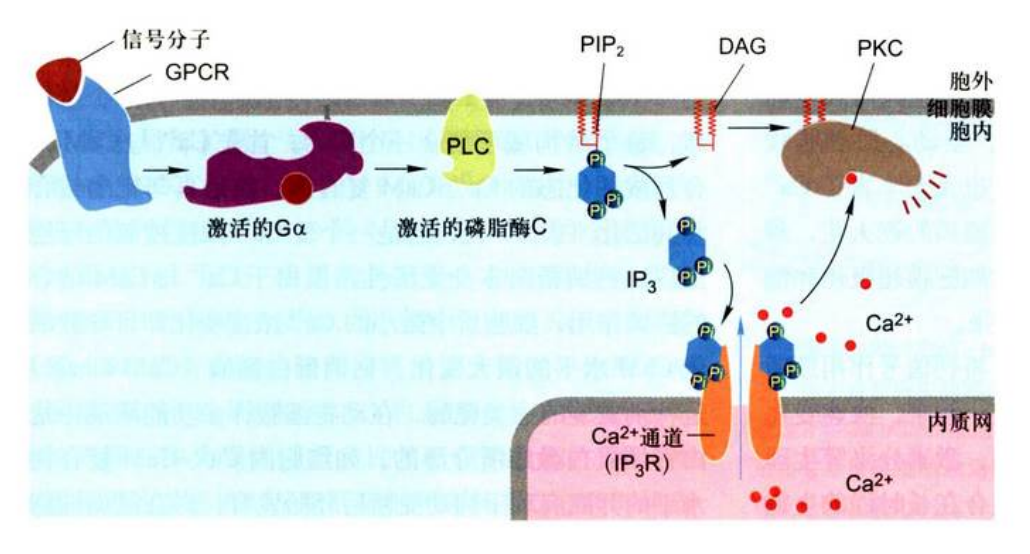
胞外信号分子与GPCR结合, 活化G蛋白(Goα或Gqα), 进而激活磷脂酶C(PLC),催化PIP2水解生成IP3和DAG两个第二信使。
$IP_3-Ca^{2+}$信号通路与钙火花
信号传递: IP3通过细胞内扩散, 结合并开启内质网膜上IP3敏感的Ca2+通道, 引起Ca2+顺电化学梯度从内质网钙库释放进入细胞质基质, 通过结合钙调蛋白引起细胞反应。
IP3引发贮存在内质网中的Ca2+转移到细胞质基质中, 使胞质中游离Ca2+浓度提高。IP3门控Ca2+通道由4个亚基组成, 每个亚基在N端胞质结构域有一个IP3结合位点, IP3的结合导致通道开放,Ca2+从内质网腔释放到细胞质基质中。这是几乎所有真核细胞内Ca2+动员的主要途径。IP3具有效应特异性。
IP3介导的Ca2+水平升高只是瞬时的, 质膜和内质网膜上Ca2+泵的启动会分别将Ca2+泵出细胞和系进内质网腔:
- 一方面, 细胞质基质中的Ca2+会促进IP3门控Ca2+通道的开启, 因为Ca2+会增加通道受体对IP3的亲和性, 促使储存Ca2+的更多释放;
- 另一方面, 细胞质基质中Ca2+浓度升高, 又会通过降低通道受体对IP3的亲和性, 抑制IP3诱导的胞内储存Ca2+的释放。当细胞中IP3通路受到刺激时, 这种由细胞质基质中Ca+对内质网膜上IP3门控Ca2+通道的复杂调控会导致细胞质基质中Ca2+水平的快速振荡。
效应作用: Ca2+不直接作用于靶蛋白, 而是通过Ca2+应答蛋白间接发挥作用。依细胞类型不同, Ca2+可徼活或抑制各种靶酶和运输系统, 改变膜的离子通透性, 诱导膜的融合或者改变细胞骨架的结构与功能。
钙调蛋白(calmodulin,CaM): 是真核细胞中普遍存在的Ca2+应答蛋白, 多肽链由148个氨基酸残基组成, 含4个结构域, 钙调蛋白的外形似哑铃,有两个球形的末端,中间被一个长而富有弹性的螺旋结构相连,每个末端有两个Ca2+结构域,每个结构域可结合一个Ca2+。钙调蛋白本身无活性, 结合Ca2+后激活靶酶:首先Ca2+与CaM结合形成活化态的Ca2+-CaM复合体, 然后再与靶酶结合将其活化, 这是一个受Ca2+浓度控制的可逆反应。
钙调蛋白激酶(CaM kinase): 是特别重要的一类靶酶, 动物细胞许多功能活动都是由钙调蛋白激酶所介导的。细胞内Ca22+-CaM复合物水平的升高有利于启动受精后胚胎发育, 兴奋肌细胞的收缩, 刺激内分泌细胞和神经元的分泌。哺乳动物脑神经元突触处一种特殊的钙调蛋白激酶十分丰富, 是构成记忆通路的组分, 失去这种钙调蛋白激酶的突变小鼠表现出明显的记忆无能。
DAG-PKC信号通路
信号传递: DAG结合在质膜上, 可活化与质膜结合的蛋白激酶C(PKC)。
PKC是Ca2+和磷脂酰丝氨酸依赖性的丝氨酸/苏氨酸蛋白激酶, 具有广泛的作用底物, 参与众多生理过程, 既涉及许多细胞”短期生理效应”如细胞分泌、肌肉收缩等, 又涉及细胞增殖、分化等”长期生理效应”。PKC有两个功能区。一个是亲水的催化活性中心, 另一个是疏水的膜结合区。在静息细胞中, PKC以非活性形式分布于细胞质中, 当细胞接受外界信号刺激时, PIP2水解, 质膜上DAG瞬间积累, 由于细胞质中Ca2+浓度升高, 导致细胞质基质中PKC与Ca2+结合并转位到质膜内表面,被DAG活化, 进而使不同类型细胞中不同底物蛋白的丝氨酸和苏氨酸残基磷酸化。
信号终止:DAG只是PIP2水解形成的暂时性产物, DAG通过两种途径终止其信使作用: 一是被DAG激酶磷酸化形成磷脂酸, 进入磷脂酰肌醇代谢途径;二是被DAG脂酶水解成单酰甘油。
效应作用:PKC的活化增强特殊基因的转录至少有两条途径:
- PKC激活一条蛋白激酶的级联反应, 导致与DNA特异序列结合的基因调控蛋白的磷酸化和激活, 进而增强特殊基因的转录;
- PKC的活化, 导致一种抑制蛋白的磷酸化, 从而使细胞质中基因调控蛋白摆脱抑制状态释放出来, 进入细胞核刺激特殊基因的转录。
酶联受体介导的信号转导
当胞外信号(配体)与受体结合即激活受体胞内段的酶活性, 这类受体至少包括5类:
- 受体酪氨酸激酶,
- 受体丝氨酸/苏氨酸激酶:
- 受体酪氨酸磷酸酯酶;
- 受体鸟苷酸环化酶:
- 酪氨酸蛋白激酶联受体。
受体酪氨酸激酶及RTK-Ras蛋白信号通路
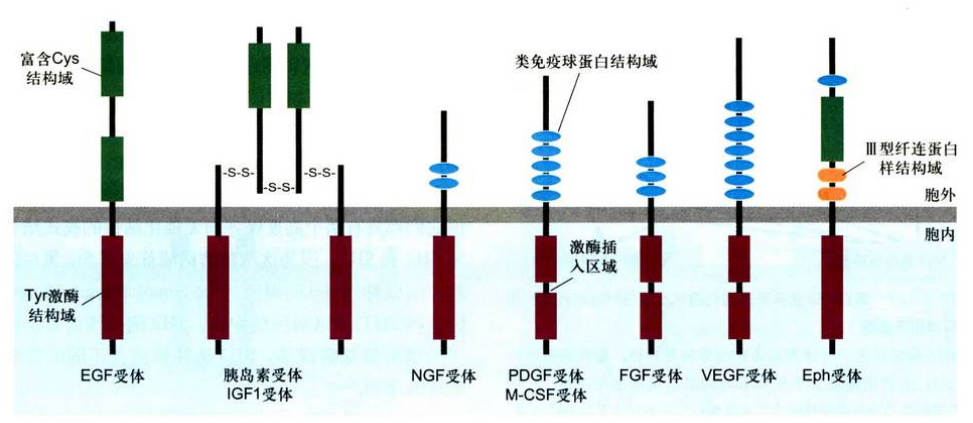
受体酪氨酸激酶(receptor tyrosine kinase, RTK): 又称酪氨酸蛋白激酶受体, 绝大多数RTK是单体跨膜蛋白, 由500-850个氨基酸残基组成, 是细胞表面一大类重要受体家族。所有RTK的N端位于细胞外, 是配体结合域, C端位于胞内, 具有酪氨酸激酶结构域, 并具有自磷酸化位点。它的胞外配体是可溶性或膜结合的多肽或蛋白类激素, 包括多种生长因子、胰岛素和胰岛素样生长因子等。RTK主要功能是控制细胞生长、分化而不是调控细胞中间代谢。
RTK活化:
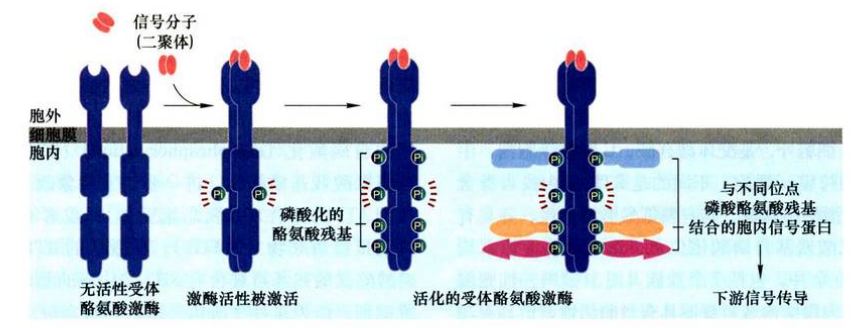
在静息状态下RTK活性很低, 当受体二聚化后, 激活受体的蛋白酪氨酸激酶活性, 进而在二聚体内彼此交叉磷酸化(cross-phosphorylation)受体胞内肽段的一个或多个酪氨酸残基, 即所谓受体的自磷酸化(autophosphorylation)。
活化 RTK 招募蛋白:
在激活的RTK内, 许多磷酸酪氨酸残基可被含有SH2结构域的胞内信号蛋白所识别, 作为多种下游信号蛋白的锚定位点, 启动信号传导。活化的RTK通过磷酸酪氨酸残基可以结合多种细胞质中带有SH2结构域的蛋白:
一类是接头蛋白, 其作用是偶联活化受体与其他信号蛋白, 参与构成细胞内信号转导复合物, 但它本身不具酶活性, 也没有传递信号的性质;
另一类是在信号通路中有关的酶。
它们都具有两个高度保守而无催化活性的结构城即SH2和SH3。SH2选择性结合不同位点的磷酸酪氨酸残基, SH3选择性结合不同的富含脯氨酸的基序。
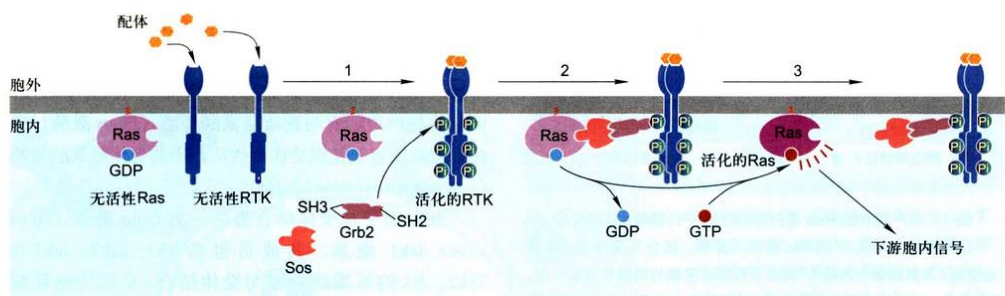
Ras的激活:
两种胞质蛋白提供了RTK与Ras蛋白的联系:一个是生长因子受体结合蛋白GRB2,具有SH2结构域, 可直接与活化受体特异性磷酸酪氨酸残基结合, GRB2还具有两个SH3结构域, 能结合并激活另一种胞质蛋白Sos, 即GRB2作为一种接头蛋白既与活化受体上特异磷酸酪氨酸残基结合又与胞质蛋白鸟苷酸交换因子Sos结合, 具有鸟苷酸交换因子活性的Sos蛋白与Ras结合导致活化Ras的构象改变, 使非活性的Ras-GDP转换成有活性的Ras-GTP。
Ras蛋白(Ras protein):是大鼠肉瘤的英文缩写。Ras蛋白是原癌基因c—ras的表达产物, 属单体GTP结合蛋白, 具有弱的GTP酶活性。Ras蛋白的活性状态对细胞的生长、分化、细胞骨架、蛋白质运输和分泌等都具有影响, 其活性则是通过与GTP或GDP的结合进行调节。Ras的活性受两个蛋白的控制,一个是鸟苷交换因子(GEF);另一个控制Ras蛋白活性的是GTP酶激活蛋白(GAP),存在于正常细胞中,主要作用是激活Ras蛋白的GTP酶。
Ras蛋白GTP-GDP转换机制:
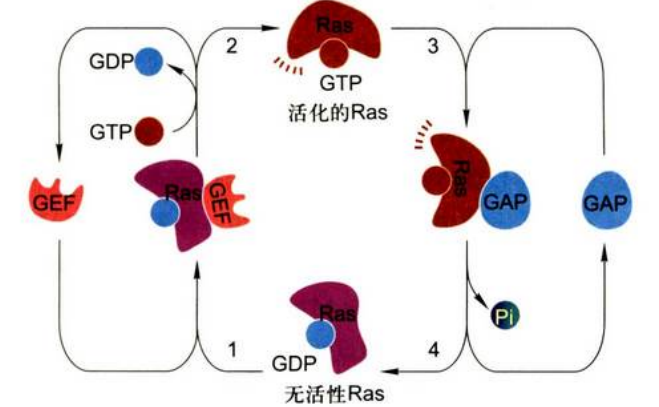
Ras蛋白是ras基因表达产物, 是小的单体GTP结合蛋白, 具有GTPase活性, 分布于质膜胞质一侧,结合GTP时为活化态, 而结合GDP时为失活态, Ras蛋白是GTPase开关蛋白。在细胞中, Ras蛋白的活性受GAP的调节, 它能刺激Ras蛋白GTPase活性增高10万倍。Ras蛋白从失活态到活化态的转变, 先要GDP释放才有GTP的结合, GDP的释放需要鸟苷酸交换因子(GEF)参与;Ras蛋白从活化态到失活态的转变, 则要GTP酶活化蛋白(GAP)的促进。)
Ras 蛋白的活化诱导不同类型细胞的分化或增殖。已有大量研究表明,约30%的人类恶性肿瘤与ras基因突变有关,因为突变的 Ras 蛋白能够与 GTP 结合,但不能将其水解成GDP,所以这种突变的Ras蛋白被“锁定”在开启状态,结果引起赘生性细胞增生。”
Ras-MAPK磷酸化级联反应的基本步骤:
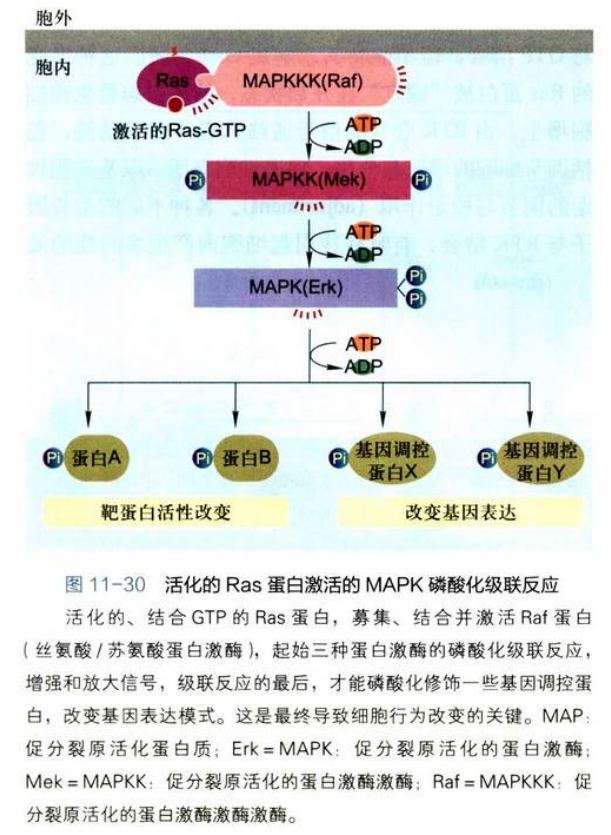
- 活化的Ras蛋白与Raf的N端结构域结合并使其激活, Raf是丝氨酸/苏氨酸蛋白激酶(又称MAPKKK), 它使靶蛋白上的丝氨酸/苏氨酸残基磷酸化;丝氨酸/苏氨酸残基磷酸化的蛋白的代谢周转比酪氨酸残基磷酸化的蛋白慢, 这有利于使短寿命的Ras-GTP信号事件转变为长寿命的信号事件;
- 活化的Raf结合并磷酸化另一种蛋白激酶MAPKK,使其丝氨酸/苏氨酸残基磷酸化导致MAPKK的活化;
- MAPKK是一种双重特异的蛋白激酶, 它能磷酸化其唯一底物MAPK的苏氨酸和酪氨酸残基使之激活。
- 促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK): 在RTK-Ras通路的蛋白激酶磷酸化级联反应中是一种特别重要的组分。活化的MAPK进入细胞核, 可使许多底物蛋白的丝氨酸/苏氨酸残基磷酸化, 包括调节细胞周期和细胞分化的特异性蛋白表达的转录因子, 从而修饰它们的活性。
综上所述, RTK-Ras-MAPK信号通路可概括为:配体→RTK→Ras→Raf(MAPKKK)→MAPKK一→MAPK→进入细胞核→其他激酶或基因调控蛋白(转录因子)的磷酸化修饰, 对基因表达产生多种效应。
RTK介导的信号通路的功能
包括调节细胞的增殖与分化, 促进细胞存活, 以及细胞代谢的调节与校正作用。各种不同的生长因子与RTK结合, 往往引起细胞内产生多向性的效应(pleiotropicefect), 包括早期和晚期基因表达。
PI3K-PKB(Akt)信号通路
PI3K-PKB(Akt)信号通路及其组成
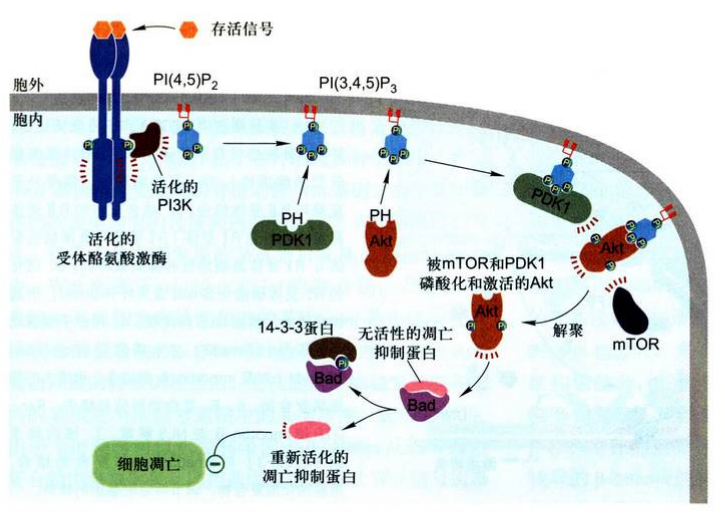
PI3K-PKB(Akt)信号通路始于RTK和细胞因子受体的活化, 产生磷酸化的酪氨酸残基, 从而为募集PI3K向膜上转位提供锚定位点。
磷脂酰肌醇-3-激酶(PI3K): 既具有Ser/Thr激酶活性, 又具有磷脂酰肌醇激酶的活性。PI3K由2个亚基组成:一个pll0催化亚基; 一个p85调节亚基, 具有SH2结构域, 可结合活化的RTK和多种细胞因子受体胞内段磷酸酪氨酸残基, 被募集到质膜, 使其催化亚基靠近质膜内小叶的磷脂酰肌醇。在膜脂代谢中, 具有磷脂酰肌醇激酶活性的PI3K催化PIP生成PIP2, 催化PIP2生成PIP3。这些与膜结合的PI-3-P为多种信号转导蛋白提供了锚定位点, 进而介导多种下游信号通路。
PKB是一种Ser/Thr蛋白激酶, 与PKA和PKC均有很高的同源性, 该激酶被证明是反转录病毒癌基因v-akt的编码产物, 故又称Akt, 其N端还含有一个PH结构域, 能紧密结合PIP2和PIP3分子的3位磷酸基团。
PKB的活化: 在静息状态下, 2种磷脂酰肌醇组分均处于低水平, PKB以非活性状态存在于细胞质基质中, 在生长因子等激素刺激下, PIP水平升高, PKB凭借PH结构域与3位P结合而转位到质膜上, 同时PKB被PH结构城掩盖而抑制的催化位点活性得以释放。PKB转位到细胞膜上对其部分活化, 它的完全活化还需要另外2种Ser/Thr蛋白激酶, 一个是PDK1借助其PH结构域转位到膜上并使PKB活性位点上的关键苏氨酸残基磷酸化, 另一个是PDK2(通常是mTOR)磷酸化PKB上丝氨酸残基, 上述2个位点被磷酸化后, PKB才完全活化。完全活化的PKB从质膜上解离下来, 进入细胞质基质和细胞核, 进而磷酸化多种相应的靶蛋白, 产生影响细胞行为的广泛效应。
PI3K-PKB信号通路的生物学作用
PI3K-PKB信号通路参与多种生长因子、细胞因子和细胞外基质等的信号转导, 具有广泛的生物学效应, 特别是在防止细胞调亡、促进细胞存活以及影响细胞糖代谢等方面具有重要作用。
- PI3K-PKB信号通路对细胞生存的促进作用是活化的PKB所诱发的诸多细胞反应中最值得关注的事件。活化的PKB可以直接使前体调亡蛋白磷酸化并产生短期效应以防止激活导致细胞死亡的凋亡途径。对许多培养细胞, 活化的PKB也可以产生长期效应, 即通过磷酸化转录因子多个Ser/Thr残基,使其与细胞质中磷酸丝氨酸结合蛋白14-3-3结合而滞留在细胞质中, 不能进入核内使凋亡基因转录, 结果降低细胞凋亡效应而促进细胞存活。
- PI3K-PKB信号通路的另-一个重要生物学作用是促进胰岛素刺激的葡萄糖摄取与储存。
TGF-β受体及其TGF-β-Smad信号通路
转化生长因子β(transforming growth factorB,TGF-B):是由多种动物细胞合成与分泌、以非活性形式储存在细胞胞外基质中结构相关的信号分子超家族。无活性的分泌前体需经蛋白酶水解作用形成以二硫键连接的同源或异源二聚体, 即成熟的活化形式。TGF-B不仅会影响细胞的增殖、分化, 而且在创伤愈合、细胞外基质的形成、胚胎发育、组织分化、骨重建、免疫调节以及神经系统的发育中都有重要作用。
TGF-B-Smad信号通路:
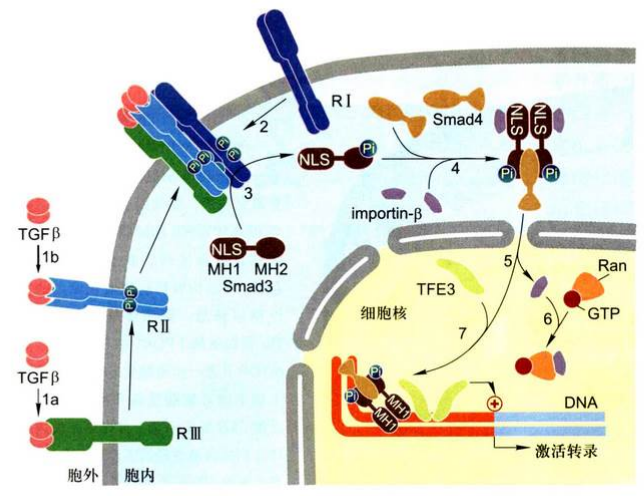
- 某些细胞中, TGF-β与RIII受体结合, 并由RIII将信号分子传递给Rll受体(具有组成型激酶活性);有些细胞中, 信号分子直接与RIl受体结合。
- 结合配体的Rll受体募集并磷酸化RI受体(RI受体不直接结合配体), RI受体激酶活性的抑制被释放。
- 活化的RI受体磷酸化Smad3或另外R-Smad, 引起构象改变, 解除NLS的掩蔽。
- 两分子磷酸化的R-Smad(Smad3)与未磷酸化的co-Smad(Smad4)以及imp-β相结合, 形成大的细胞质复合物。
- 复合物转位到核内, Ran-GTP使imp-β与NLS解离。
- 核内转录因子(TFE3)与Smad3/Smad4复合物结合, 形成活化型复合物, 调节特定靶基因的转录。
细胞因子受体与JAK-STAT信号通路
细胞因子(cytokine): 是影响和调控多种类型细胞增殖、分化与成熟的活性因子, 包括白介素、干扰素、集落刺激因子、促红细胞生成素和某些激素(如生长激素和催乳素)等, 它们组成一个信号分子家族, 其成员相对分子质量相对较小。细胞因子对多种细胞类型的发育, 特别是在造血细胞和免疫细胞的生长、分化与成熟中起重要调控作用。
细胞因子受体(cytokine receptor): 是细胞表面一类与酪氨酸蛋白激酶偶联的受体。这类受体蛋白单次跨膜, 由两条或多条肽链组成, 受体本身不具有酶活性, 但它的胞内段具有与胞质酪氨酸蛋白激酶的结合位点, 受体活性依赖于非受体酪氨酸蛋白激酶。
Janus 激酶(JAK):与细胞因子受体相连的胞质酪氨酸蛋白激酶是一类新近发现的Janus 激酶(JAK)家族,JAK 的 N 端结构域与受体结合,C 端为激酶结构域。每种激酶成员与特异的细胞因子受体结合。
信号转导子和转录激活子(STAT):在激酶的直接底物中发现一类新的衔接子蛋白是基因转录调节因子,称为信号转导子和转录激活子(STAT),STAT 蛋白 N 端具有 SH2 结构域和核定位信号(NLS),中间为DNA结合域,C 端有一个保守的、对共活化至关重要的酪氨酸残基。具有信号转导和转录激活的双重功能。
JAK-STAT信号通路的基本步骤如下:
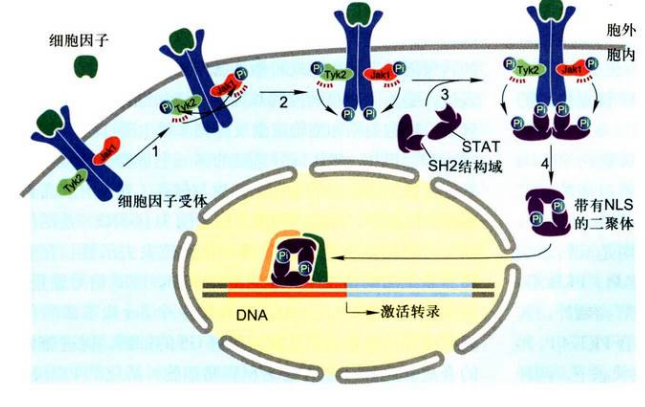
- 细胞因子与质膜受体特异性结合, 引发受体构象改变并导致二聚化, 形成同源二聚体。受体二聚化有助于各自结合的Jak相互靠近, 使彼此酪氨酸残基发生交叉磷酸化, 从而激话Jak的活性。
- 活化的Jak继而磷酸化受体胞内段酪氨酸残基,使活化受体.上磷酸酪氨酸残基成为具有SH2结构域的STAT或具有PTB结构域的其他胞质蛋白的锚定位点。
- STAT通过SH2结构域与受体磷酸化的酪氨酸残基结合, 继而STAT的C端酪氨酸残基被JAK磷酸化。磷酸化的STAT分子即从受体.上解离下来。
- 两个磷酸化的STAT分子依靠各自的SH2结构域结合形成同源二聚体, 从而暴露其核定位信号NLS。二聚化的STAT转位到细胞核内与特异基因的调控序列结合, 调节相关基因的表达。
效应: 不同的STAT在不同的细胞内调节不同的基因转录。该通路对细胞增殖、分化、迁移和凋亡等生物学过程都具有重要的调节作用。
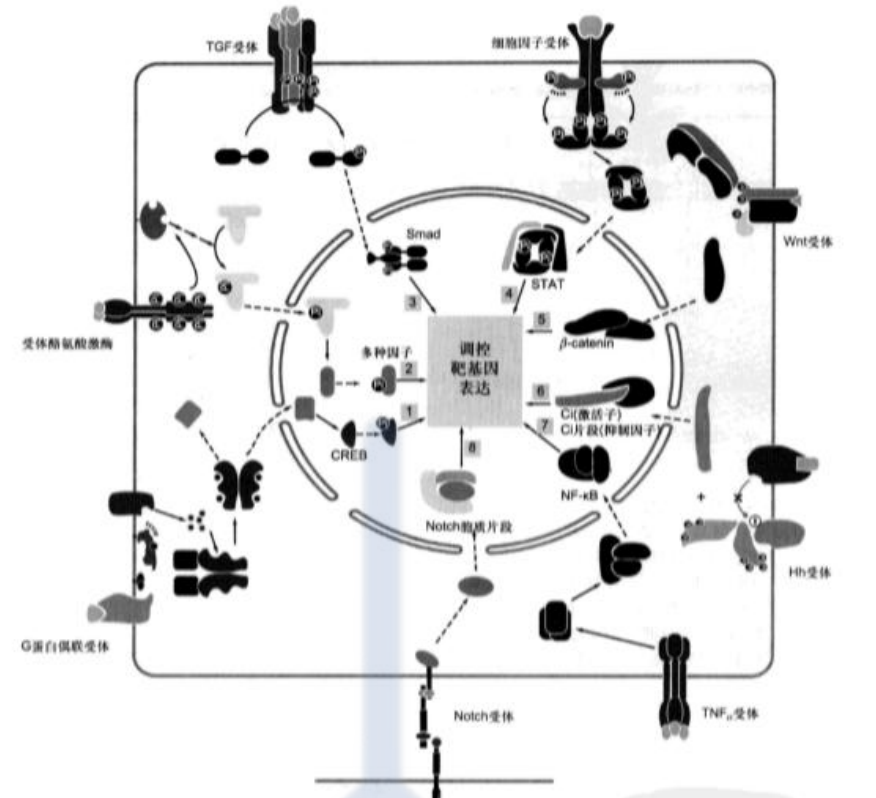
其他细胞表面受体介导的信号通路
Wnt-β-catenin信号通路
Wnt-β-catenin信号通路步骤:
- 缺乏Wnt信号时, β-catenin与Axin介导的胞质蛋白复合物结合, 利于β-catenin被GSK3磷酸化, 磷酸化的β-catenin泛素化后被蛋白酶体识别和降解, 转录因子TCF与抑制因子结合在核内作为阻遏物抑制靶基因转录。
- 有Wnt信号时, Wnt信号与受体Fz结合, 引发LRP被GSK3和其他激酶磷酸化, 从而使Axin与LRP结合, 致使Axin/APC/GSK3/β- -catenin复合物解离, 避免β-catenin被GSK3磷酸化而免于降解并在细胞中富集, 转位到核内与TCF结合, 激活靶基因转录。
Hedgehog受体介导的信号通路
Hedgehog(Hh)信号分子是一种由信号细胞所分泌的局域性蛋白质配体, 作用范围很小, 一般不超过20个细胞。在脊椎和无脊椎动物的诸多发育过程中, Hedgehog信号通路控制细胞命运、增殖与分化, 该信号通路被异常激活时, 会引起肿瘤的发生与发展。
Hedgehog受体介导的信号通路步骤:
在缺乏Hh信号情况下, 受体Ptc蛋白抑制胞内膜泡上的Smo蛋白, 而胞质调节蛋白形成复合物并与微管结合, 在复合物中转录因子Ci被各种激酶磷酸化, 磷酸化的Ci在泛素/蛋白酶体相关的F-box蛋白Slimb的作用下水解形成Ci75片段, 作为应答Hh信号基因的阻遏物发挥作用, 进入核内抑制靶基因表达。
在有Hh存在情况下, Hh与Ptc结合, 抑制Ptc活性, 引发PIc内化并被消化, 从而解除对Smo的抑制。然后Smo通过膜泡融合移位到质膜, 并被CK1和PKA两种激酶磷酸化, 与Smo结合的Cos2和Fu蛋白超磷酸化, 致使Fu/Cos2/Ci复合物从微管上解离下来, 从而形成稳定形式的Ci。Ci进入核内并与CREB结合蛋白(CBP)结合, 作为靶基因的转录激活子而发挥作用。
NF-κB信号通路
NF-κB是一种核转录因子, 能特异性结合免疫球蛋白κ轻链基因的上游增强子序列并激活基因转录, 它广泛存在于几乎所有真核细胞中。NF-κB通常以异二聚体形式存在于细胞质中, 两个亚基p65和p50在N端共享一个同源区, 以确保其二聚化并与DNA结合, 核定位信号(NLS)也位于此同源区。
NF-κB信号通路可调控多种参与炎症反应的细胞因子、黏附因子和蛋白酶类基因的转录过程, 以应答多种胞外信号刺激, 并影响细胞增殖、分化及发育。
传导机制:
在细胞处于静息状态时, NF-κB在细胞质中与一种抑制物I-κBα结合, 处于非活化状态, 同源区的NLS也因抑制物的结合被掩盖。
- 当细胞受到外界信号刺激时, 胞质中异三聚体I-κB激酶被激活并磷酸化I-κB抑制物N端2个丝氨酸残基。
- E3泛素连接酶快速识别I-κB的磷酸化丝氨酸残基并使I-κB发生多聚泛素化, 进而导致I-κB被泛素依赖性蛋白酶体降解。
- I-κB的降解使NF-κB解除束搏并暴露NLS,然后NF-κB转位进人核内激活靶基因的转录。
Notch信号通路
Notch受体蛋白是由Notch基因编码的膜蛋白受体家族, 从无脊椎动物到人类都广泛表达, 在结构上具有高度保守性。Notch受体蛋白的胞外区包含多个EGF样的重复序列及其与配体的结合位点;胞内区含多种功能序列, 是Notch受体蛋白完成信号转导的关键区域。Notch的配体又称DSL。
Notch信号通路是一种细胞间接触依赖性的通讯方式。信号分子及其受体均是膜整合蛋白。信号激活的受体发生两次切割, 释放转录因子, 调节应答细胞的分化方向, 决定细胞的发育命运。
Notch信号通路机制:
- Notch蛋白首先以单体膜蛋白形式在内质网合成, 然后转运至高尔基体, 在高尔基体反面管网区被蛋白酶切割, 产生一个胞外亚单位和一个跨膜-胞质亚单位;在没有与其他细胞的配体相互作用时, 两个亚单位彼此以非共价键结合;
- 随着与相邻信号细胞的配体(Delta)的结合, 效应细胞的Notch蛋白便发生两次蛋白切割过程:Notch蛋白首先被结合在膜上的基质金属蛋白酶ADAM切割, 然后释放出Notch的胞外片段;
- 第二次切割发生在Notch蛋白疏水的跨膜区, 由4个蛋白亚基组成的跨膜复合物γ分泌酶负责催化完成, 切割后释放Notch蛋白的胞质片段;
- 该胞质片段是Notch的活性形式, 它立即转位到核内与其他转录因子协同作用, 调节靶基因的表达, 从而影响发育过程中细胞命运的决定。
细胞表面整联蛋白介导的信号转导
整联蛋白(integrin): 是细胞表面的跨膜蛋白, 由a和β两个亚基组成异二聚体, 作为跨膜接头在细胞外基质和细胞内肌动蛋白骨架之间起双向联络作用, 将i细胞外基质同细胞内骨架网络连成一个整体。整合蛋白不仅介导细胞与胞外基质黏附, 起结构整合作用, 更重要的是提供了一种信号途径, 通过胞外环境调控细胞内活性。
黏着斑(focal adhesion): 是细胞与胞外基质之间形成的复杂的大分子复合物, 黏着斑含有成簇的整联蛋白、细胞质蛋白和成束的肌动蛋白纤维(应力丝), 黏着斑的装配既受信号控制又具有信号转导功能。通过黏着斑由整联蛋白介导的信号通路有两条:
1.由细胞表面到细胞核的信号通路:
- 细胞表面整联蛋白与胞外配体相互作用, 导致整联蛋白簇集和定位在黏着斑结构中的酪氨酸激酶Src的活化;
- 活化的Src使黏着斑激酶FAK的酪氨酸残基磷酸化, 磷酸酪氨酸残基可结合具有SH2结构域的接头蛋白Grb2和胞内鸟苷酸交换蛋白Sos;
- 活化的Grb2- Sos复合物引起Ras蛋白GTP-GDP交换而活化, 活化的Ras-GTP通过MAPK级联反应途径传递细胞生长促进信号到细胞核, 激活涉及细胞生长与增殖相关的基因转录。
2.由细胞表面到胞质核糖体的信号通路:
当黏着斑激酶FAK的酪氨酸残基被Src磷酸化后, 便为磷脂酰肌醇激酶(PI3K)的SH2结构域提供结合位点。活化的PI3K催化磷脂酰肌醇产生两种衍生物: PI-3,4-二磷酸和PI-3, 4, 5-三磷酸, 二者作为膜结合信使活化激酶p70s6k,活化的p70s6k进而磷酸化核糖体小亚基的S6蛋白。在蛋白质合成过程中, 含有磷酸化S6蛋白的核糖体被优先利用, 翻译某些特定mRNA,合成细胞从G期运行到S期所需要的某些蛋白。
细胞信号转导的整合与控制
细胞的应答反应特征
对特定胞外信号产生多样性细胞反应的机制通常有3种情况:
- 细胞外信号的强度或持续时间的不同控制反应的性质。
- 在不同细胞中,相同受体因不同的胞内信号蛋白可引发不同的下游通路。
- 细胞通过整合不同通路的输入信号调节细胞对信号的反应。
蛋白激酶的网络整合信息
信号的控制:受体的脱敏与下调
靶细胞对信号分子脱敏机制的五种方式:
- 对多种肽类或其他激素受体发生脱敏反应:
- 受体没收(receptor sequestration):细胞通过配体依赖性的受体介导的内吞作用减少细胞表面可利用受体的数目,以网格蛋白/AP 包被膜泡形式摄入细胞,内吞泡脱包被形成无包被的早期胞内体,受体被暂时扣留,受 pH 降低的影响(pH 5.0),受体-配体复合物在晚期胞内体解离,扣留的受体可返回质膜再利用,配体进入溶酶体被消化。
- 有时即使缺乏配体结合的情况下,细胞通过批量膜流(bulk membrane flow)也会使细胞表面受体以相对较低的速率被内化(internalization),然后再循环利用,从而减少细胞表面可利用受体的数目。
- 受体下调(receptor down-regulation):通过受体介导的内吞作用,受体-配体复合物转移至胞内溶酶体消化降解而不能重新利用,因此细胞通过表面自由受体数目减少和配体的清除导致细胞对信号敏感性下调。
- 受体失活(receptor inactivation):G 蛋白偶联受体激酶(GRK)使结合配体的受体磷酸化,再通过与胞质抑制蛋白β-arrestin 结合而阻断与 G 蛋白的偶联作用,这是一种快速使受体脱敏的机制。
- 信号蛋白失活(inactivation of signaling protein):致使细胞对信号反应脱敏的原因不在于受体本身,而在于细胞内信号蛋白发生改变,从而使信号级联反应受阻,不能诱导正常的细胞反应。
- 抑制性蛋白产生(production of inhibitory protein):受体结合配体而被激活后,在下游反应中产生抑制性蛋白并形成负反馈环从而降低或阻断信号转导途径。
考点补充
名词补充
蛋白激酶(protein kinases, 简称PK)。催化蛋白质磷酸化过程的酶。蛋白质的磷酸化过程是神经信息在细胞内传递的最后环节.导致离子通道蛋白及通道门的状态变化。在神经细胞内有许多种类。在半静状态下, 处于小活动状态。根据其活化条件的不同, 可分为蛋白激酶A、蛋白激酶G、蛋白激酶C和钙调蛋白的蛋白激酶。