细胞生物学 第六章 蛋白质分选与膜泡运输
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25 ____ __ ____ __
/\ _`\ /\ \__ __ /\ _`\ /\ \__ __
\ \ \L\ \_ __ ___\ \ ,_\ __ /\_\ ___ \ \,\L\_\ ___ _ __\ \ ,_\/\_\ ___ __
\ \ ,__/\`'__\/ __`\ \ \/ /'__`\/\ \ /' _ `\ \/_\__ \ / __`\/\`'__\ \ \/\/\ \ /' _ `\ /'_ `\
\ \ \/\ \ \//\ \L\ \ \ \_/\ __/\ \ \/\ \/\ \ /\ \L\ \/\ \L\ \ \ \/ \ \ \_\ \ \/\ \/\ \/\ \L\ \
\ \_\ \ \_\\ \____/\ \__\ \____\\ \_\ \_\ \_\ \ `\____\ \____/\ \_\ \ \__\\ \_\ \_\ \_\ \____ \
\/_/ \/_/ \/___/ \/__/\/____/ \/_/\/_/\/_/ \/_____/\/___/ \/_/ \/__/ \/_/\/_/\/_/\/___L\ \
/\____/
\_/__/
__
/\ \
__ ___ \_\ \
/'__`\ /' _ `\ /'_` \
/\ \L\.\_/\ \/\ \/\ \L\ \
\ \__/.\_\ \_\ \_\ \___,_\
\/__/\/_/\/_/\/_/\/__,_ /
__ __ ___ ______ __
/\ \/\ \ __ /\_ \ /\__ _\ /\ \__
\ \ \ \ \ __ ____/\_\ ___\//\ \ __ \/_/\ \/ _ __ __ ___ ____ _____ ___ _ __\ \ ,_\
\ \ \ \ \ /'__`\ /',__\/\ \ /'___\\ \ \ /'__`\ \ \ \/\`'__\/'__`\ /' _ `\ /',__\/\ '__`\ / __`\/\`'__\ \ \/
\ \ \_/ \/\ __//\__, `\ \ \/\ \__/ \_\ \_/\ __/ \ \ \ \ \//\ \L\.\_/\ \/\ \/\__, `\ \ \L\ \/\ \L\ \ \ \/ \ \ \_
\ `\___/\ \____\/\____/\ \_\ \____\/\____\ \____\ \ \_\ \_\\ \__/.\_\ \_\ \_\/\____/\ \ ,__/\ \____/\ \_\ \ \__\
`\/__/ \/____/\/___/ \/_/\/____/\/____/\/____/ \/_/\/_/ \/__/\/_/\/_/\/_/\/___/ \ \ \/ \/___/ \/_/ \/__/
\ \_\
\/_/
细胞内蛋白质的分选
蛋白质分选(protein sorting): 指核编码的蛋白质均在细胞质基质中的核糖体上开始合成, 然后转运至细胞的特定部位, 进一步装配成具有结构和功能的复合体, 参与细胞的生命活动。蛋白质分选不仅保证了蛋白质的正确定位, 也保证了蛋白质的生物学活性。包含共翻译转运和后翻译转运
信号假说与蛋白质分选信号
信号假说(signal hypothesis)要点为:
- 分泌蛋白的合成始于细胞质中的游离核糖体;
- 合成的N端信号序列暴露出核糖体后, 靠自由碰撞与内质网接触, 然后靠N端信号序列的疏水性插入内质网的膜;
- 蛋白质继续合成, 并以袢环形式穿过内质网的膜;
- 如果合成的是分泌蛋白, 除了信号序列被信号肽酶切除外, 全部进入内质网的腔, 若是膜蛋白, 则由一个或多个停止转移信号将蛋白质锚定在内质网膜上。
1.指导分泌蛋白在rER上合成的因素: 信号肽序列(决定因素)、信号识别颗粒、信号识别颗粒受体
信号肽(signal peptide): 是由mRNA上特定的信号顺序首先编码合成的一段短肽, 含15-30个氨基酸残基, 它作为与糙面内质网膜结合的”引导者”指引核糖体与曹勉内质网结合, 并决定新生肽链插入膜内或进入内腔。
信号识别颗粒(signal recognition particle, SRP): 信号识别颗粒是一种核糖核蛋白复合体, SRP能够识别刚从游离核糖体上合成出来的信号肽, 并与之结合, 暂时中止新生肽的合成, 同时与内质网上的停靠蛋白结合,使核糖体附着到内质网膜上, 并进行新生肽的转移。
信号识别颗粒的受体(signal recognition particle receptor, SRPR): 又称停泊蛋白(dockingprotein), 即SRP在内质网膜上的受体蛋白,它能够特异性与结合有信号序列的SRP牢牢地结合, 使正在合成蛋白质的核糖体停靠到内质网上来。
2.蛋白质在膜上的位置决定
(1)有信号肽序列的肽链, 在rER上合成, 无此序列的, 注定在细胞质基质中合成;
(2)只有起始转移序列, 没有停止转移序列的肽链, 合成后的肽链进入内质网腔;
(3)肽链中部如果有一个停止转移序列, 合成的肽链最终成为单次跨膜蛋白;
(4)如果有多个停止转移序列, 合成的肽链最终成为多次跨膜蛋白。
内在停止转移锚定序列(internal stop-transfer anchor sequence, STA)和内在信号锚定序列(internal signal-anchor sequence, SA): 肽链中还可能存在某些内在序列与内质网膜有很强的亲和力从而使之结合在脂双层之中, 这段序列不再转入内质网腔中, 称之为内在停止转移锚定序列和内在信号锚定序列。
导肽(leader peptide): 是一种信号序列, 它是游离核糖体上合成的蛋白质的N-端信号, 通常带正电荷的碱性氨基酸含量较为丰富, 对于蛋白质的定位具有重要作用。导肽运送蛋白质时具有以下特点:①需要受体; ②消耗ATP; ③需要分子伴侣; ④要电化学梯度驱动; ⑤要信号肽酶切除信号肽; ⑥通过接触点进入;⑦非折叠形式运输。
蛋白质分选转运的基本途径与类型
核基因编码的蛋白质的分选大体可分2条途径:
1.共翻译转运过程
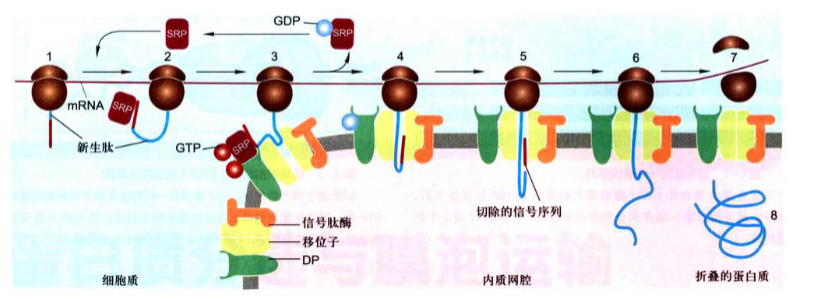
共翻译转运(cotranslational translocation): 蛋白质合成在游离核糖体上起始之后, 由信号肽及其与之结合的SRP引导转移至糙面内质网, 然后新生肽边合成边转入糙面内质网腔或定位在ER膜上, 经转运膜泡运至高尔基体加工包装再分选至溶酶体、细胞质膜或分泌到细胞外, 由于这种转运定位是与蛋白质翻译的同时进行的,故称为共翻译转运。内质网与高尔基体本身的蛋白质分选也是通过这一途径完成的。
a.蛋白质首先在细胞质基质游离核糖体上起始合成, 当多肽链延伸至80个左右氨基酸残基时, N端的内质网信号序列暴露出核糖体并与信号识别颗粒结合, 导致肽链延伸暂时停止, 防止新生肽N端损伤和成熟前折叠;
b.直至信号识别颗粒与内质网膜上的SRP受体结合;
c.核糖体/新生肽与内质网膜的移位子结合,信号识别颗粒脱离了信号序列和核糖体, 返回细胞质基质中重复使用, 肽链又开始延伸。以环化构象存在的信号肽与移位子组分结合并使孔道打开, 信号肽穿入内质网膜并引导肽链以袢环的形式进入内质网腔中, 这是一个耗能过程;
d.腔面上的信号肽酶切除信号肽并快速使之降解;
e.肽链继续延伸;
f.直至完成整个多肽链的合成, 蛋白质进入腔内并折叠, 核糖体释放, 移位子关闭。
2.后翻译转运
后翻译转运(post-translational translocation): 游离核糖体上合成的蛋白质必须等蛋白质完全合成并释放到胞质溶胶后才能被转运,所以将这种转运方式称为后翻译转运。通过这种方式转运的蛋白质包括线粒体、叶绿体和细胞核的部分蛋白,以及过氧化物酶体的全部蛋白等。在游离核糖体上合成的蛋白质中有相当一部分直接存在于胞质溶胶中, 包括细胞骨架蛋白、各种反应体系的酶或蛋白等。
根据蛋白质分选的转运方式或机制不同, 又可将蛋白质转运分为4类:
- 跨膜转运(transmembrane transport): 主要是指共翻译转运途径中, 在细胞质基质中起始合成的蛋白质, 在信号肽-SRP介导下转移到内质网, 然后边合成边转运或进入内质网腔或插入内质网膜;此外是指后翻译转运途径中, 在细胞质基质核糖体上完成合成的多肽链在不同靶向信号序列指导下, 依不同的机制转运到线粒体、叶绿体和过氧化物酶体等细胞器。
- 膜泡运输(vesicular transport): 蛋白质分选的一种特有的方式, 普遍存在于真核细胞中。在转运过程中不仅涉及蛋白质本身的修饰、加工和组装, 还涉及多种不同膜泡靶向运输及其复杂的调控过程。蛋白质被不同类型的转运膜泡从糙面内质网合成部位转运至高尔基体进而分选转运至细胞的不同部位, 其中涉及供体膜出芽形成不同的转运膜泡、膜泡运输以及膜泡与靶膜的融合等过程。
- 选择性的门控转运(gated transport): 在细胞质基质中合成的蛋白质通过核孔复合体在核-质间双向选择性地完成核输入或核输出的一种转运方式。
- 细胞质基质中蛋白质的转运: 依靠在细胞骨架上的定向运输。
蛋白质向线粒体, 叶绿体和过氧化物酶体的分选
分子伴侣(molecular chaperone): 存在于原核生物和真核生物细胞质以及细胞器中可协助新生肽链正确折叠的一类蛋白质。其主要功能为①帮助蛋白质的折叠和装配②帮助蛋白质的转运和定位③参与细胞器结构的发生④应激反应⑤参与信号转导。包括热休克蛋白Hsp60和Hsp70两个家族。另外, 使用ATP协助蛋白质折叠只是一部分分子伴侣的功能, 分子伴侣如Asf1者, 能在细胞分裂过程中提升DNA解螺旋酶的活性并且将母链的组蛋白传递到了链。分子伴侣主要有三大类: 伴侣蛋白、热激蛋白70家族和热激蛋白90家族。
蛋白质从细胞质基质输入到线粒体
1.蛋白质从细胞质基质输入到线粒体基质
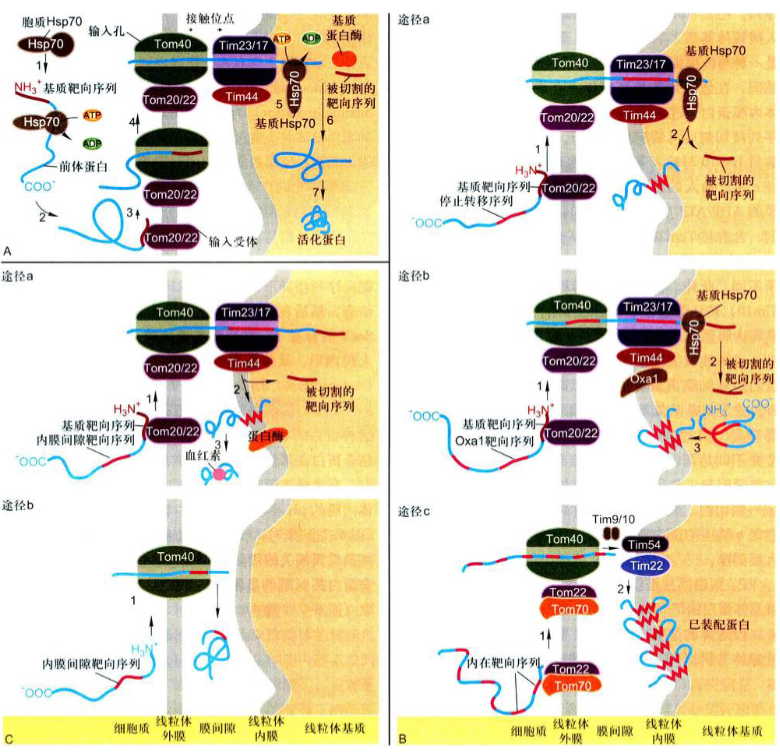
基本步骤:
- 在游离核糖体上合成的前体蛋白, 与胞质蛋白分子伴侣Hsc70结合, 并使其保持未折叠或部分折叠状态, 其N端具有基质靶向序列;
- 前体蛋白与内外膜接触点附近的输入受体(Tom20/22)结合;
- 被转运进入输入孔;
- 输入的蛋白进而通过内外膜接触点的输入通道(外膜为Tom40, 内膜为Tim23/17);
- 线粒体基质分子伴侣Hsc70与输入蛋白结合并水解ATP以驱动基质蛋白的输入。输入的基质蛋白其基质靶向序列, 在基质蛋白酶作用下被切除, 同时Hsc70也从新输入的基质蛋白上释放出来;
- 进而折叠, 产生活性构象。
2.蛋白质以三种途径从细胞质基质输入线粒体内膜
a. 利用Tom40为输入孔道, 外膜上Tom22/20作为识别N端基质靶向序列的输入受体, 内膜转运蛋白都是Tim23/17, 但通过途径B输入的内膜蛋白;
b. 具有N端基质靶向序列, 还具有内在的疏水结构域, 前者引导前体蛋白进入线粒体基质, 后者可被内膜蛋白Oxal所识别, Oxal是一种与细菌中涉及内膜蛋白插入的相关蛋白, 由线粒体基因组编码, 在线粒基质核糖体上合成。这类线粒体内膜蛋白通过途径B, 其前体先进入基质, 基质靶向序列被切割后再装配到内膜上;输入的内膜蛋白是多次跨膜蛋白, 缺少N端基质靶向序列, 含有被Tom70/Tom22输人受体识别的多个内在靶向序列。
c. 此外, 在途径C中两种膜间隙蛋白(Tim9/10)被认为起分子伴侣的作用, 协助输人蛋白在外膜与内膜通道之间的转运。
3.线粒体蛋白通过两条途径从细胞质基质输人到线粒体膜间隙
- 途径A: 从细胞质基质输入到线粒体膜间隙的主要途径, 其过程与内膜蛋白途径A类似, 但主要不同是蛋白质内在靶向序列预定其定位在膜间隙, 并且在转运过程中被内膜上蛋白酶于膜间隙一侧切割, 然后释放的蛋白质折叠井与血红素结合。
- 途径B: 转运的蛋白通过外膜Tom40输入孔, 直接进入膜间隙。
叶绿体基质蛋白与类囊体蛋白的靶向输入
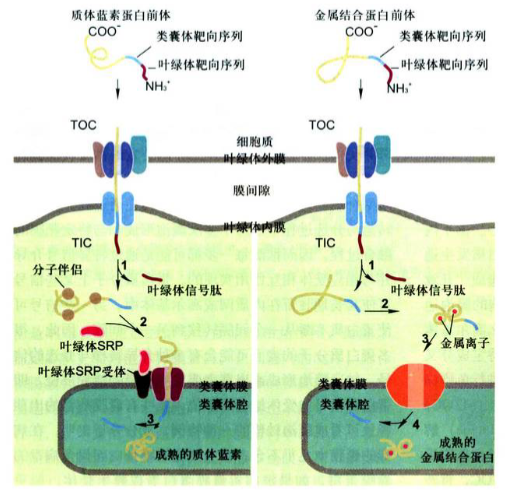
(1)叶绿体基质蛋白: 向叶绿体基质靶向运输过程和线粒体基质蛋白的输入基本相似, 前体蛋白以非折叠形式输入, 输入过程依赖于基质Hse70蛋白催化ATP水解提供能量。
(2)类囊体蛋白:
- N端基质靶向序列被基质蛋白酶切除, 从而使类囊体靶向序列暴露;
- 进入基质后两种蛋白的转运途径产生分歧
- SRP依赖途径:①质体蓝素蛋白和类似的蛋白在基质空间保持非折叠状态, 分子伴侣参与,在类囊体靶向序列指导下与叶绿体SRP结合, 然后在类囊体膜上叶绿体SRP受体和转运蛋白SecY的介导下。转运到类囊体腔;②进入腔内后, 质体蓝素蛋白的类囊体靶向序列被内切蛋白酶切除, 蛋白质折叠产生成熟构象。
- pH依赖的途径:①非折叠的金属结合蛋白的N端基质靶向序列首先被切除, 然后金属结合蛋白在基质中折叠并与其辅助因子结合;②在类囊体靶向序列N端的两个精氨酸残基和跨叶绿体内膜的pH梯度是折叠蛋白输入到类囊体腔所必需的;③类囊体膜上的转运蛋白至少由4种与细菌质膜相关的蛋白组成, 输入到类囊体腔的金属结合蛋白其N端的类囊体靶向序列被切除, 产生成熟的构象。
过氧化物酶体蛋白的分选
所有蛋白质都是由核基因编码, 在细胞质基质中合成的, 然后输入到预存或新增殖产生的过氧化物酶体中。可溶性细胞质受体识别并结合具有C端SKL序列的基质蛋白将其靶向运输到过氧化物酶体的基质中。
基本步骤:
- 含有过氧化物酶体靶向序列(PTSI)的基质蛋白, 其C端信号序列为3肽SKL,它首先与胞质中可溶性Pex5受体蛋白结合;
- 结合基质蛋白的Pex5受体再与过氧化物酶体膜上的Pex14受体相互作用;
- 可溶性Pex5受体和膜结合的Pex14受体似乎与SRP和SRP受体的功能有相似性。基质蛋白-Pex5受体复合物通过定位在过氧化物酶体膜上的一组蛋白质复合物(Pex10/Pex12Pex2)转运到基质中;
- 在转运过程或在基质中, Pex5与Pex10/12/2复合物解离返回细胞质基质中再利用;
注意: 折叠好的基质蛋白在C端PTS1指导下可以输入到过氧化物酶体基质中, 但其信号序列不被切除。
细胞内膜泡运输
膜泡运输概观
膜流(membrane flow)或(membrane fluidity): 细胞内膜系统中各细胞器膜性成分的相互移位和转移。膜流具有高度组织性、方向性井维持动态平衡。
细胞内膜泡运输需要多种转运膜泡参与, 根据转运膜泡表面包被蛋白的不同, 目前发现有3种不同类型: COP II包被膜泡、COP I包被膜泡和网格蛋白厂接头蛋白包被膜泡, 它们分别介导不同的膜泡转运途径。)
COP II 包被膜泡的装配与运输
COP II包被膜泡介导细胞内顺向运输,即负责从内质网到高尔基体的物质运输。
COP II组成成分:
- Sarl: GTP酶, 结合GDP失活, 结合GTP活化;调节包被的装配与去装配;召集其他包被蛋白形成包被。
- Sec23/Sec24复合体: 和Sarl一起构成包被内层。
- Sec13/Sec31复合体: 构成包被外层。
- Sec16: 可能作为骨架蛋白起作用。
- Sec12: Sarl的鸟苷酸交换因子。
- COPII包被膜泡的装配过程:
- 1.细胞质中可溶性Sar1-GDP与ER膜蛋白Sec12相互作用, 催化GTP置换GDP形成Sar1-GTP, GTP的结合引发Sar1构象改变暴露出疏水N端并插入ER膜, 膜结合的Sar1对包被蛋白的进一步装配起募集者作用;
- 2.Sar1与膜的结合提供了随后Sec23/Sec24复合物的结合位点, 从而在ER膜出芽区形成三重复合物Sar1-GTP/ Sec23/ Sec24 ;
- 3.Sec13/Sec31复合物与三重复合物结合。纯化的Sec13和Sec31蛋白具有自组装形成网格结构的特点, 因而发挥COPII包被骨架的作用。大的纤维蛋白Sec16结合在ER膜的胞质表面, 一方面与已装配的复合物相互作用, 另一方面组织其他包被蛋白的结合, 从而增加包被蛋白的聚合效率。当包被组装完成以后, Sec23亚基促进GTP被Sar1水解;
- 4.Sar1-GDP从膜泡上释放, 引发包被去装配而解聚。
COP I包被膜泡的装配与运输
COP I包被膜泡介导细胞内膜泡逆向运输, 负责从高尔基体反面膜囊到高尔基体顺面膜囊以及从高尔基体顺面网状区到内质网的膜泡转运, 包括再循环的膜脂双层、内质网驻留的可溶性蛋白和膜蛋白, 是内质网回收错误分选的逃逸蛋白的重要途径。
COP I组成成分: COP I包被是一种胞质溶胶蛋白含有7种不同的蛋白质亚基和一种调节膜泡转运的GTP结合蛋白ARF。GTP结合蛋白ARF。ARF是一种结合GDP/GTP转换的分子开关调控蛋白, 包被蛋白复合物的装配与去装配依赖于ARF所结合的核苷酸交换与水解过程。COPI在出芽小泡的胞质溶胶面聚合, 形成外被体被膜小泡, COP I的某些亚基(如β亚基)具有衔接蛋白的作用, 可同膜蛋白的细胞质结构域结合促进小泡的形成。
COP I包被膜泡的装配过程:
- 一种胞质溶胶中的小分子GTP结合蛋白, 即ARF,释放所结合的GDP,然后同GTP结合, 形成ARF-GTP复合物, 并整合在高尔基体膜中。GDP与GTP的交换是由高尔基体膜中的一种酶催化;
- COPI同ARF以及高尔基体膜蛋白的细胞质部分结合;
- 在脂酰CoA的帮助下形成COPI被膜小泡, 一旦COPI小泡形成就立即从供体膜释放出来, COPI包被去聚合, 并与膜脱离, 这一过程是由与ARF结合的GTP水解所触发。
细胞器中的蛋白质是通过两种机制保留及回收来维持的:
- 转运膜泡将驻留蛋白有效排斥在外, 例如, 有些驻留蛋白参与形成大的复合物, 因而不能被包装在出芽形成的转运膜泡中, 结果被保留下来;
- 对逃逸蛋白的回收机制, 使之返回它们正常驻留的部位。回收逃逸的内质网蛋白是通过回收信号介导的特异性受体完成的。内质网的正常驻留蛋白, 不管在腔内还是在膜上, 它们在C端含有一段回收信号序列, 如果它们意外地被包装进入转运膜泡从内质网逃逸到高尔基体CGN, 则CGN区的膜结合受体蛋白将识别并结合这些逃逸蛋白的回收信号, 形成COP I包被膜泡将它们回收到内质网。内质网腔中的可溶性蛋白, 均具有典型的KDEL回收信号。如果一个内质网的蛋白缺乏KDEL序列, 那么这种蛋白将不能返回内质网, 而是被转运膜泡带到质膜。
网格蛋白/接头蛋白包被膜泡的装配与运输
- 网格蛋白/接头蛋白包被膜泡介导几种蛋白质分选途径, 包括从高尔基体TGN向胞内体或向溶酶体、植物细胞液泡的运输。在受体介导的胞吞途径中还负责将物质从细胞表面运往胞内体转而到溶酶体的运输。
- 网格蛋白包被膜泡组成成分: 网格蛋白(clathrin)由3个二聚体组成, 每个二聚体包括1条重链和1条轻链。3个二聚体形成三脚蛋白复合体, 是包被的结构单位。
- 网格蛋白包被膜泡的装配过程:当配体与膜上受体结合后, 网格蛋白聚集在膜下, 逐渐形成直径50~100nm的质膜凹陷, 称网格蛋白包被小窝。一种小分子GTP结合蛋白一发动蛋白(dynamin)在深陷的包被小窝的颈部组装成环 , 发动蛋白水解与其结合的GTP引起颈部缢缩 , 最终脱离质膜形成网格蛋白包被膜泡(clathrin-coated vesicle)。几秒钟后, 网格蛋白便脱离包被膜泡返回质膜附近区域以便重复使用, 脱包被的囊泡与早胞内体(early endosome)融合, 从而将转运分子及胞外液体摄入细胞。
需要注意的是, 在大分子跨膜转运中, 网格蛋白本身并不起捕获特异转运分子的作用, 有特异性选择作用的是包被中另一类衔接蛋白(adaptin), 它既能结合网格蛋白, 又能识别跨膜受体胞质面的尾部肽信号, 从而通过网格蛋白包被膜泡介导跨膜受体及其结合配体的选择性运输。
细胞结构体系的组装
考点补充
蛋白质分选与膜泡运输 超级重要
- 蛋白质分选有哪些主要途径与类型?如果某种蛋白质在合成后不含信号序列,它将定位于细胞中何处?并解释其原因(2010)
- 简述分泌型蛋白的合成与其跨内质网膜共翻译转运过程。(2012)
- 论述真核细胞中分泌性蛋白合成和共翻译转运途径过程。(2015)
- 简述蛋白质合成的转运途径及方式(2017)
- 真核细胞的分泌蛋白是如何进入内质网的?分泌过程?(2023简)
名词补充
信号序列(signal sequence): 蛋白质多肽链上的一段连续的特定氨基酸序列具有分选信号的功能。可位于多肽链的任何部位, 有的完成分选任务后被切除。
衔接蛋白, 街头蛋白(adaptor protein): 在大分子跨膜转运中, 网格蛋白本身并不起捕获特异转运分子的作用, 有特异性选择作用的是包被中另一类衔接蛋白(adaptin), 它既能结合网格蛋白, 又能识别跨膜受体胞质而的尾部肽信号, 从而通过网格蛋白包被膜泡介导跨膜受体及其结合配体的选择性运输。
膜泡运输(vesicular transport): 蛋白质分选的一种特有的方式, 普遍存在于真核细胞中。在转运过程中不仅涉及蛋白质本身的修饰、加工和组装, 还涉及多种不同膜泡靶向运输及其复杂的调控过程。蛋白质被不同类型的转运膜泡从糙面内质网合成部位转运至高尔基体进而分选转运至细胞的不同部位, 其中涉及供体膜出芽形成不同的转运膜泡、膜泡运输以及膜泡与靶膜的融合等过程。
受体没收(receptor sequestration): 细胞通过配体依赖性的受体介导的内吞作用减少细胞表而可利用受体的数目, 以网格蛋白/ AP包被膜泡形式摄入细胞, 内吞泡脱包被形成无包被的早期胞内体, 受体被暂时扣留, 受pH降低的影响(pH 5.0), 受体.配体复合物在晚期胞内体解离, 扣留的受体可返回质膜再利用, 配体进入溶酶体被消化。
cristae
嵴(cristae): 是指线粒体内膜向内折叠形成的结构, 增大了线粒体内膜的总表而积, 为线粒体产能生化反应提供了充足的场所.嵴的形状、数量和排列与细胞种类及生理状况密切相关。在不同的真核生物中, 线粒体嵴的形态不同《动物细胞中常见”袋状嵴”、植物细胞多为”管状嵴”。需求较多的细胞中线粒体嵴的数量较多。
Leucoplast
Leucoplast白色体质体的一种, 不含色素, 存在于植物的分生组织和储藏组织中。它可以储藏淀粉、蛋白质和油脂。由于前质体在发育分化过程中一直处于黑暗中, 发育的顺序发生了改变, 使内部的膜结构形成了片层体。如果将发育成熟的具有叶绿体的绿色植物置于黑暗中, 这种植物的叶绿体也会转变成白色体。有些细胞的白色体含有原叶绿素, 见光后可以转变成叶绿素。
thylakoid
类囊体(thylakoid): 在叶绿体基质中, 有许多由单位膜封闭而成的扁平小囊, 称为类囊体, 多个类囊体叠置成垛, 称为基粒, 是高等植物的特有结构。所有的类囊体彼此相通大大增加膜片层的而积, 更有效地捕获光能。类囊体包括光合作用能量转换功能的全部组分。类囊体的化学组成与其他膜有明显差别, 与叶绿体光合作用的功能有关。
Mitochondrial diesaes
线粒体病(Mitochondrial diesaes)是遗传缺损引起线粒体代谢酶缺陷, 致使ATP合成障碍、能量来源不足导致的一组异质性病变。线粒体脑皿病的不同类型发病年龄不同。线粒体是密切与能量代谢相关的细胞器, 无论是细胞的成活(氧化磷酸化)和细胞死亡(凋亡)均与线粒体功能有关, 特别是呼吸链的氧化磷酸化异常与许多人类疾病有关。根据线粒体病变部位不同可分为:
- 线粒体肌病, 线粒体病变侵犯骨骼肌为主。
- 线粒体脑, 肌病病变同时侵犯骨骼肌和中枢神经系统。
Nuclear-cytoplasmic interaction
核质互作(Nuclear-cytoplasmic interaction)是指在生物细胞内, 胞核和细胞质之间相互交流和作用的过程。它是维持细胞正常功能和调节细胞发育的重要机制。在核质互作中, 胞核通过转录产生RNA, 然后运输到细胞质中参与蛋白质合成或其他生物化学反应;同时, 细胞质中的信号分子也能够进入胞核, 影响基因的表达和转录。这种相互作用能够帮助细胞对外部环境变化做出适应性调整, 并能够促进细胞分化、生长和分裂。